Professional Documents
Culture Documents
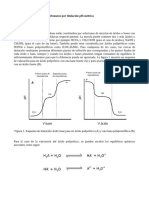
1 Introduccion
Uploaded by
esajuaniOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
1 Introduccion
Uploaded by
esajuaniCopyright:
Available Formats
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
FUNDAMENTOS DE ANLISIS INSTRUMENTAL. 1 RELACIN DE PROBLEMAS.
PROBLEMAS BSICOS DE DISOLUCIONES 1.- Una disolucin de cido sulfrico tiene una densidad de 1.28 g mL-1 y contiene 37.0 % en peso de H2SO4. a) Calcular la molaridad, normalidad y molalidad de la solucin. b) Cul es la fraccin molar del H2SO4? c) Qu volumen de este cido contienen 10 g de H2SO4? d) Cuntos mL de la disolucin deben ser diluidos con agua para obtener un litro de una disolucin que contenga 10.0 % en peso de H2SO4? e) En qu proporcin debe ser mezclada esta disolucin con una disolucin de H2SO4 0.50 N para obtener 10.0 L de una disolucin de H2SO4 1.00 M?
Datos: Pm (H2SO4) = 98.08 g mol ; Pm (H2O) 18.015 g mol Solucin: a) 4.83 M 9.66 N 5.99 m b) 0.097 c) 21.1 mL d) 224.4 N e) 1.64:8.36 L:L
-1 -1
2.- De una disolucin compuesta por 54.35 g de KOH y 439.50 g de H2O, con una densidad de 1.0873 g mL-1, calcular: a) el porcentaje en peso de KOH b) el porcentaje de volumen de KOH c) la concentracin en g L-1
Datos: Pm (KOH) = 56.1 g mol ; Pm (H2O) 18.015 g mol -1 Solucin: a) 11 % b) 11,97 % c) 119,7 g L
-1 -1
3.- Calcular la cantidad de BaCl2.2H2O que es necesario utilizar para preparar: a) 0.5 L de disolucin que contenga 100 ppm de BaCl2. b) 0.5 L de disolucin que contenga un 5 % (en volumen) de Ba. c) 1 L de disolucin que contenga 0.01 g de BaCl2 por mL.
Datos: Pm (BaCl2.2H2O) = 244.27 g mol ; Pm (BaCl2) = 208.25 g mol ; P.at (Ba) = 137.34 g mol Solucin: a) 58.65 mg b) 44.46 g c) 11.73 g
-1 -1 -1
4.- Sobre 400 mL de una disolucin de sosa de concentracin desconocida se aaden 5 g de hidrxido sdico puro, y al disolverse no se aprecia variacin de volumen. Se toman 20 mL de la solucin resultante, se diluyen hasta 100 mL y se valoran con cido clorhdrico 0.200 N, gastndose 50 mL. Qu masa de sosa contenan los 400 mL iniciales?
Dato: Pm (NaOH) = 40.0 g mol Solucin: 3 g
-1
5.- Tomamos 0.4000 g de una muestra problema en la que queremos determinar un compuesto X, los disolvemos y los llevamos a un matraz de 250 mL (Disolucin A). De esta disolucin tomamos 5 mL y los llevamos a un matraz aforado de 25 mL, enrasando con agua (Disolucin B). Tomamos 8 mL de esta disolucin y los ponemos en una cubeta cilndrica, medimos su concentracin por un mtodo instrumental y resulta ser de 5.00 ppm en la disolucin de la cubeta. Calcular la concentracin del compuesto X en el matraz A y el porcentaje de X en la muestra original
Solucin: 25 mg L 1.56 %
-1
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
6.- Se desea analizar un frmaco llamado atazanavir usado para el tratamiento del VIH (virus de inmunodeficiencia humana) mediante una tcnica instrumental. Para ello se consigui de la casa comercial 100 mg de ste compuesto en forma de sal sulfatada. Cuntos mg tendremos que pesar en la balanza analtica de atazanavir para hacer una disolucin de 1000 ppm como disolucin madre en un matraz de 25 mL? Qu volumen tengo que coger para hacer una disolucin estndar de 5 ppb (g/L) en 10 mL a partir de la disolucin madre previamente preparada? Haz los clculos necesarios para hacer una disolucin intermedia y discute breve y razonadamente si esta dilucin sera necesaria.
Datos: Pm de atazanavir sulfatado (C38H52N6O7H2SO4) = 802,9 g mol Solucin: a) 28.48 mg b) 0.05 L c) si sera necesario
-1
PROBLEMAS BSICOS DE CALIBRACIN. TECNICAS INSTRUMENTALES. 7.- En la determinacin de una especie X por un mtodo instrumental en el que la seal analtica se define como P = kCx, se obtuvieron los siguientes datos de calibracin: Concentracin de X, ppm Seal analtica, P 0 0,031 2 0,173 6 0,422 10 0,702 14 0,956 18 1,248
a) Representa y calcula la ecuacin de la curva de calibrado. b) Calcular la concentracin molar de X en una muestra, si al medir la intensidad de la seal analtica se obtiene un valor de P = 0,532. c) Sabiendo que la desviacin estndar absoluta del blanco es sb = 0.0079, calcula el lmite de deteccin y de cuantificacin del compuesto X usando ste mtodo instrumental. d) Define la sensibilidad del calibrado y calcula la sensibilidad analtica del mtodo propuesto.
Dato: Pm (X) = 207.2 g mol -5 Solucin: a) y = 0,0670x + 0.03001; b) 3.615x10 M; c)LOD = 0.353 y LOQ = 1.180; d) 0.067 y 0.143
-1
8.- Se llev a cabo la determinacin de un metal M en vinos mediante una tcnica ptica (absorcin atmica). Para ello, en cinco matraces aforados de 50 mL se pusieron 10 mL de vino y se le aadieron a cada uno de ellos 0, 5, 10, 15 y 20 mL de una disolucin patrn de M conteniendo una concentracin de 10 mg L-1 de dicho metal. Seguidamente, los matraces se enrasaron con agua desionizada y se midi la absorbancia de cada una de ellas obteniendo los siguientes valores: 0.040, 0.062, 0.081, 0.102, 0.135. Realiza un esquema del experimento propuesto y explica brevemente que tipo de mtodo de calibracin se ha usado para la determinacin del M. Finalmente calcula la ecuacin de la recta de regresin y obtn la concentracin del M en el vino (mg L-1).
Solucin: 8.26 mg L de M
-1
9.- Un acero de alto grado se analiz para ver su contenido en Mn, usando para su determinacin Fe como estndar interno. Se prepar una muestra estndar que contena Fe y 5 mg L-1 de Mn cuya lectura de intensidades absolutas fueron 8.0 (2933 A) y 10.2 (2932 A) respectivamente. Una muestra desconocida de acero se trat de la misma forma, es decir, se le aadi la misma concentracin de Fe y se midieron las intensidades absolutas a las longitudes de onda correspondientes para cada metal obtenindose valores de 8.2 y 12.5 para Fe y Mn respectivamente. Explica brevemente en qu consiste el mtodo de calibracin usando patrn interno y calcula la concentracin de Mn en la muestra de acero desconocida.
Solucin: 5.98 mg L de Mn
-1
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
1.- Una disolucin de cido sulfrico tiene una densidad de 1.28 g mL-1 y contiene 37.0 % en peso de H2SO4. a) Calcular la molaridad, normalidad y molalidad de la solucin. b) Cul es la fraccin molar del H2SO4? c) Qu volumen de este cido contienen 10 g de H2SO4? d) Cuntos mL de la disolucin deben ser diluidos con agua para obtener un litro de una disolucin que contenga 10.0 % en peso de H2SO4? e) En qu proporcin debe ser mezclada esta disolucin con una disolucin de H2SO4 0.50 N para obtener 10.0 L de una disolucin de H2SO4 1.00 M?
Datos: Pm (H2SO4) = 98.08 g mol ; Pm (H2O) 18.015 g mol Solucin: a) 4.83 M 9.66 N 5.99 m b) 0.097 c) 21.1 mL d) 224.4 N e) 1.64:8.36 L:L
-1 -1
= 1.28 g mL-1; Riqueza = 37% en peso; PM H2SO4 = 98.08; P eq H2SO4 = 49.04. a) Base de clculo = 1L de disolucin. MOLARIDAD, M
gramos soluto M= moles soluto = Litros disolucin Peso molecular Litros disolucin
gramos soluto = 1280 x
37 = 473.6 gH 2 SO4 100
M=
473.6
98.08 = 4.83(mol L1 ) 1
NORMALIDAD, N
gramos soluto N= equivalentes soluto = Litros disolucin Peso equivalente Litros disolucin
gramos soluto N= Peso molecular valencia = M x valencia Litros disolucin
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
En reacciones cido-base, la valencia del cido sulfrico es 2, dado que es capaz de ceder dos protones. Por lo que el peso equivalente es la mitad del peso molecular, es decir la normalidad es el doble de la molaridad. N = M x valencia = 4.83 x 2 = 9.66 eq L-1. MOLALIDAD, m
gramos soluto m= moles soluto = Kg disolucin Peso molecular Kg disolucin
1 litro de disolucin peso 1280 gramos, 473.6 gramos son de cido sulfrico y (1280-473.6) 806.4 son de agua, por tanto:
m=
473.6
98.08 = 5.99 mol Kg 1 0.8064
b) FRACCION MOLAR, en una disolucin de dos componentes 1 y 2:
1 =
moles de1 moles de1 = moles totales moles de1 + moles de 2
2 =
moles de 2 moles de 2 = moles totales moles de1 + moles de 2
De tal manera que 1 +2 = 1
473.6 18 1 = = 9.73x102 2 = 1 1 = 0.9027 473.6 806.4 + 18 18
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
c) dividiendo los gramos entre el peso molecular del cido sulfrico, tenemos los moles. Luego es un problema de una simple dilucin. Aplicamos:
moles1 = C1 x V1 = C2 x V2 = moles2
moles1 = 10 = 0.102 moles = 4.83 xV2 V2 = 21.1mL 98.08
d) debemos conseguir un litro de una disolucin del 10% peso en cido sulfrico. por una parte: volument total = 1000 = mL H2O + mL H2SO4 (suponemos volmenes aditivos) de otra parte: masa total = masa H2O + masa H2SO4; donde: masa H2O = mL H2O masa H2SO4 = mL H2SO4 x H2SO4 masa total = mL H2O *90/100 ya que el agua constituye el 90% en peso. Por tanto: mL H2O *100/90 = mL H2O + mL H2SO4 x H2SO4 Falta obtener la densidad del cido sulfrico para poder resolver el sistema de dos ecuaciones con dos incgnitas. Tal densidad la podemos obtener de la disolucin original. 1000 mL de esta disolucin se corresponden con 806.4 mL de agua y 193.6 mL de cido sulfrico, que segn los datos de riqueza y densidad de esta disolucin pesan 473.6 g. Por tanto:
H SO =
2 4
masa 473.6 g = = 2.446 g mL1 volumen 193.6mL
Combinando ambas ecuaciones: mL H2O *100/90 = mL H2O + (1000-mL H2O) x 2.446 mL H2O * (100/90-1+2.446) = 2446 resolviendo: mL H2O = 956.5 mL H2SO4 = 43.5 Por tanto, la masa de cido sulfrico
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
Masa H2SO4 = mL H2SO4 x x = 106.3 g La concentracin molar de cido sulfrico en esta disolucin:
M=
106.3
98.08 = 1.083(mol L1 ) 1
El volumen a tomar de la disolucin original:
moles1 = C1 x V1 = C2 x V2 = moles2
1.083 mol L-1 x 1000 mL = 4.83 mol L-1 x V2 V2 = 224.4 mL e) Se ha de solucionar un sistema de dos ecuaciones con dos incgnitas, en el que participan tres disoluciones. Siempre que los volmenes sean aditivos: (1) moles1 + moles2 = moles3 C1V1 + C2V2 = C3V3 (2) V1 + V2 = V3 Tenemos en cuenta que la disolucin es 0.5 N en cido sulfrico, es decir 0.25 M. (1) 4.83V1 + 0.25V2 = 1 x 10 (2) V1 + V2 = 10 Resolviendo
4.83 0.25 V1 1 x = 1 1 V2 10
V1 = 1.638 L V2 = 8.362 L V2/V1 = 5.1 = 5+1/10
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
2.- De una disolucin compuesta por 54.35 g de KOH y 439.50 g de H2O, con una densidad de 1.0873 g mL-1, calcular: a) el porcentaje en peso de KOH b) el porcentaje de volumen de KOH c) la concentracin en g L-1
Datos: Pm (KOH) = 56.1 g mol ; Pm (H2O) 18.015 g mol -1 Solucin: a) 11 % b) 11,97 % c) 119,7 g L
-1 -1
a)
% peso =
peso analito x100 peso muestra
% peso =
54.35 x100 = 11.0% 54.35 + 439.5
b) El porcentaje en volmenes el peso de potasa por cien mililitros de disolucin. En 100 mL encontramos:
%v = 1087.3 g muestraL1 x0.1L *
11gKOH = 11.96% 100g muestra
c) Los gramos por litro es 10 veces el porcentaje en volumen, es decir 119.6 gL-1
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
3.- Calcular la cantidad de BaCl2.2H2O que es necesario utilizar para preparar: a) 0.5 L de disolucin que contenga 100 ppm de BaCl2. b) 0.5 L de disolucin que contenga un 5 % (en volumen) de Ba. c) 1 L de disolucin que contenga 0.01 g de BaCl2 por mL.
Datos: Pm (BaCl2.2H2O) = 244.27 g mol ; Pm (BaCl2) = 208.25 g mol ; P.at (Ba) = 137.34 g mol Solucin: a) 0.0586 mg b) 44.46 g c) 11.73 g
-1 -1 -1
a) 100 mg L-1 * 0.5 L = 50 mg de BaCl2 puro. Al partir de la sal hidratada se ha de aplicar el factor gravimtrico
mg BaCl2 2 H 2O = mg BaCl2 x
b)
Pm BaCl2 2 H 2O 244.27 = 50 x = 58.65 mg Pm BaCl2 208.25
g BaCl2 2 H 2O =
c)
5 gBa Pm BaCl2 2 H 2O 244.27 x 500mL x = 5 x5 x = 44.6 g 100mL Pat Ba 137.34
10 2 gBaCl2 Pm BaCl2 2 H 2O 244.27 g BaCl2 2 H 2O = x 103 mL x = 101 x = 11.73 g 1mL Pm BaCl2 208.25
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
4.- Sobre 400 mL de una disolucin de sosa de concentracin desconocida se aaden 5 g de hidrxido sdico puro, y al disolverse no se aprecia variacin de volumen. Se toman 20 mL de la solucin resultante, se diluyen hasta 100 mL y se valoran con cido clorhdrico 0.200 N, gastndose 50 mL. Qu masa de sosa contenan los 400 mL iniciales?
Dato: Pm (NaOH) = 40.0 g mol Solucin: 3 g
-1
Los moles de HCl gastados son los moles de NaOH valorados: 20 mL * CNaOH = 50 mL * 0.2 M CNaOH = 0.5 M Tal concentracin en 400 mL se corresponden con los siguientes gramos de NaOH:
gramos soluto M= Peso molecular 0.5 = Litros disolucin
gNaOH 40 0.4
g NaOH = 8. Como se han aadido 5 g, los 400 mL contenan, inicialmente, 8-5 = 3 g.
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
5.- Tomamos 0.4000 g de una muestra problema en la que queremos determinar un compuesto X, los disolvemos y los llevamos a un matraz de 250 mL (Disolucin A). De esta disolucin tomamos 5 mL y los llevamos a un matraz aforado de 25 mL, enrasando con agua (Disolucin B). Tomamos 8 mL de esta disolucin y los ponemos en una cubeta cilndrica, medimos su concentracin por un mtodo instrumental y resulta ser de 5.00 ppm en la disolucin de la cubeta. Calcular la concentracin del compuesto X en el matraz A y el porcentaje de X en la muestra original
Solucin: 25 mg L 1.56 %
-1
De la disolucin A a la B se ha diluido (25/5) 5 veces el analito X. Luego la concentracin en A es cinco veces mayor que en B: [X]A = [X]B * dilucin = 5 * 25/5 = 25 ppm % X en la muestra = masa X/masa muestra * 100 = 25 mg L-1 * 0.250 L *10-3 g/mg /0.4 g * 100 = 1.56%
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
6.- Se desea analizar un frmaco llamado atazanavir usado para el tratamiento del VIH (virus de inmunodeficiencia humana) mediante una tcnica instrumental. Para ello se consigui de la casa comercial 100 mg de ste compuesto en forma de sal sulfatada. Cuntos mg tendremos que pesar en la balanza analtica de atazanavir para hacer una disolucin de 1000 ppm como disolucin madre en un matraz de 25 mL? Qu volumen tengo que coger para hacer una disolucin estndar de 5 ppb (g/L) en 10 mL a partir de la disolucin madre previamente preparada? Haz los clculos necesarios para hacer una disolucin intermedia y discute breve y razonadamente si esta dilucin sera necesaria.
Datos: Pm de atazanavir sulfatado (C38H52N6O7H2SO4) = 802,9 g mol Solucin: a) 28.48 mg b) 0.05 L c) si sera necesario
-1
Pm (C38H52N6O7H2SO4) = 802.9 g mol -1 Pm (C38H52N6O7) = 704.86 g mol -1
a) Utilizando el factor gravimtrico, 1000 ppm de atazanavir equivalen a los siguientes mg de la sal sulfatada: mg atazanavirH2SO4 = mg atazanavir * pm atazanavirH2SO4/pm atazanavir mg atazanavirH2SO4 = 1000*802.9/704.86 = 1139.09 mg En un litro se deben pesar 1139.09 mg, en 25 mL, 40 veces menos: 1139.09 * 25/1000 = 28.48 mg
b) VAxCA = VBxCB 1000 ppm x VA(mL) = 5x10-3 ppm x 10 (mL) VA = 5x10-5 mL = 0.05 L = 50 nL. Se debe preparar una disolucin intermedia dado el pequeo volumen obtenido, que es difcil medir.
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
7.- En la determinacin de una especie X por un mtodo instrumental en el que la seal analtica se define como P = kCx, se obtuvieron los siguientes datos de calibracin: Concentracin de X, ppm Seal analtica, P 0 0,031 2 0,173 6 0,422 10 0,702 14 0,956 18 1,248
e) Representa y calcula la ecuacin de la curva de calibrado. f) Calcular la concentracin molar de X en una muestra, si al medir la intensidad de la seal analtica se obtiene un valor de P = 0,532. g) Sabiendo que la desviacin estndar absoluta del blanco es sb = 0.0079, calcula el lmite de deteccin y de cuantificacin del compuesto X usando ste mtodo instrumental. h) Define la sensibilidad del calibrado y calcula la sensibilidad analtica del mtodo propuesto.
Dato: Pm (X) = 207.2 g mol -5 Solucin: a) y = 0,0670x + 0.03001; b) 3.615x10 M; c)LOD = 0.353 y LOQ = 1.180; d) 0.067 y 0.143
-1
a) Dado que la relacin entre la seal analtica y la concentracin es, presumiblemente, proporcional, debemos ajustar los datos a una recta y = a + bx y comprobar que la ordenada en el origen no difiere significativamente de cero a un nivel de confianza que, analticamente, se establece en el 95% (significacin 0.05) Ajustando por mnimos cuadrados tenemos: y = 3.00*10-2+6.704*10-2 x r2 = 0.9996 syx = 1.09*10-2 sb = 7.0*10-4 sa = 7.3*10-3 t(a=0) = 4.105 tterico (95%, 4) = 2.132 Atendiendo a los valores del estadstico t, la ordenada en el origen no resulta despreciable a un nivel de confianza del 95% (significacin 0.05). Por tanto, tendremos en cuenta el valor de la ordenada en el origen a la hora de calcular la concentracin del analito X en la muestra problema. Para que fuese despreciable, tendramos que elevar el nivel de confianza hasta el 99.5%, donde t = 4.604.
1.400E+00 1.200E+00 Seal analtica 1.000E+00 8.000E-01 6.000E-01 4.000E-01 2.000E-01 0.000E+00
+0 0 2. 00 E +0 0 4. 00 E +0 0 6. 00 E +0 0 8. 00 E +0 0 1. 00 E +0 1 1. 20 E +0 1 1. 40 E +0 1 1. 60 E +0 1 1. 80 E +0 1 0. 00 E
Concentracin Datos originales Datos ajustados
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
b) Si la seal analtica asciende a 0.532, la concentracin resulta, por regresin inversa, sustituyendo en la ecuacin de la recta, x = 7.488 ppm.
y =? replicados y=? x= Sx= der %= 5.320E-01 1.000E+00 7.488E+00 1.754E-01 2.343E+00
c) LOD y LOQ
3s B 3 * 7.9 x10 3 LOD = = = 0.36 ppm b 6.704 x10 2 10s B 10 * 7.9 x10 3 LOQ = = = 1.2 ppm b 6.704 x10 2
d) Sensibilidad del calibrado y sensibilidad analtica: La sensibilidad del calibrado es el valor de la pendiente = 6.704x10-2 La sensibilidad analtica, , se define como el valor de la pendiente entre la desviacin estndar de las medidas:
b = = Ss
6.704 x10 2 = = 1.4 x10 1 n 4.7 x10 1 ( yi y ) 2 b
i =1
n 1
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
8.- Se llev a cabo la determinacin de un metal M en vinos mediante una tcnica ptica (absorcin atmica). Para ello, en cinco matraces aforados de 50 mL se pusieron 10 mL de vino y se le aadieron a cada uno de ellos 0, 5, 10, 15 y 20 mL de una disolucin patrn de M conteniendo una concentracin de 10 mg L-1 de dicho metal. Seguidamente, los matraces se enrasaron con agua desionizada y se midi la absorbancia de cada una de ellas obteniendo los siguientes valores: 0.040, 0.062, 0.081, 0.102, 0.135. Realiza un esquema del experimento propuesto y explica brevemente que tipo de mtodo de calibracin se ha usado para la determinacin del M. Finalmente calcula la ecuacin de la recta de regresin y obtn la concentracin del M en el vino (mg L-1).
Solucin: 8.26 mg L de M
-1
El vino contiene M, los matraces de calibrado adems de vino contienen concentraciones crecientes de M patrn. Se trata del mtodo de la adicin estndar. Con este mtodo, tendrmos el valor de la concentracin haciendo y = 0 y estimando x. Para la concentracin cambiamos de signo el valor de x obtenido. Se construye la siguiente tabla: Muestra 1 2 3 4 5 mL vino 10 10 10 10 10 mL M 10 ppm 0 5 10 15 20 [M] disolucin de medida, ppm 0 1 2 3 4 Absorbancia 0.040 0.062 0.081 0.102 0.135
A ttulo de ejemplo, la muestra 2 es de concentracin 5 mL x 10 ppm = 50 mL x [M] x = 5 x 10 / 50 = 1 ppm.
1.600E-01 1.400E-01 1.200E-01 Seal analtica 1.000E-01 8.000E-02 6.000E-02 4.000E-02 2.000E-02 0.000E+00 0.00E+00
1.00E+00
2.00E+00
3.00E+00
4.00E+00
Concentracin Datos originales Datos ajustados
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
y = 3.80*10-2 +2.30*10-2x r2 = 0.9880
syx = sb = sa = 4.619E-03 1.461E-03 3.578E-03
Para y = 0; [M] = 1.65 ppm (sx = 0.32, para 1 replicado). Observamos que la imprecisin es muy elevada. En el vino, la concentracin de M es mayor, ya que ste se ha diluido 5 veces (50/10) para obtener la disolucin de medida, por tanto: [M] vino = 5*1.65 = 8.3 ppm Recordatorio: El principal inconveniente de este mtodo es que se trata de un mtodo de extrapolacin, que es menos preciso que los de interpolacin. El resultado se obtienen en una zona de la grfica conde no hay puntos experimentales, por lo que cualquier variacin de la pendiente de la recta por errores indeterminados se traduce en una variacin apreciable en el resultado (el mtodo puede ser inexacto, adems de impreciso). En ambos sentidos influye el tamao de la adicin, pues hay que procurar que el tramo incierto no sea demasiado grande. Por otra parte, el mtodo de la adicin estndar puede ser difcil de automatizar, y suele necesitar cantidades mayores de muestra que cuando se utilizan otros mtodos.
DEPARTAMENTO DE QUMICA ANALTICA Y TECNOLOGA DE ALIMENTOS
9.- Un acero de alto grado se analiz para ver su contenido en Mn, usando para su determinacin Fe como estndar interno. Se prepar una muestra estndar que contena Fe y 5 mg L-1 de Mn cuya lectura de intensidades absolutas fueron 8.0 (2933 A) y 10.2 (2932 A) respectivamente. Una muestra desconocida de acero se trat de la misma forma, es decir, se le aadi la misma concentracin de Fe y se midieron las intensidades absolutas a las longitudes de onda correspondientes para cada metal obtenindose valores de 8.2 y 12.5 para Fe y Mn respectivamente. Explica brevemente en qu consiste el mtodo de calibracin usando patrn interno y calcula la concentracin de Mn en la muestra de acero desconocida.
Solucin: 5.98 mg L de Mn
-1
En el mtodo del patrn interno, se corrige la medida del analito respecto al patrn interno para as corregir las variaciones instrumentales. De tal manera que la variacin sufrida por el analito es igualmente sufrida por el patrn interno, quedando anulada tal variacin en la relacin de seales. Por tanto: El patrn de 5 ppm de Mn da una relacin de seales = 10.2/8 = 1.275 La muestra cuya concentracin de Mn queremos estimar = 12.5/8.2 = 1.524 La concentracin de Mn en la muestra de acero = 1.524 * 5/1.275= 5.98 ppm El patrn interno sirve adems para corregir tiempos de retencin en cromatografa, etc. Recordatorio: El patrn interno es una sustancia que se aade a dotas las muestras y estndares en cantidad conocida y a la vez en cantidad suficiente para poder ser determinado sin problemas. Su adicin no debe causar ningn tipo de interferencia en el anlisis, y debe proporcionar una seal analtica similar al analito en el anlisis pero distinguible del mismo. Por supuesto, no debe estar presente en la matriz en estudio. Se utiliza cuando el analista est interesado en la concentracin de uno o algunos de los componentes y el mtodo de anlisis est sujeto tanto errores sistemticos como aleatorios. El mtodo se basa en que cuando las seales del analito y el patrn interno responde proporcionalmente a las fluctuaciones del mtodo y del instrumento empleado, entonces la razn de estas seales es independiente de tales fluctuaciones. La principal ventaja es que con l se eliminan los problemas de fluctuacin instrumental, minimizndose los errores instrumentales, ya que tanto el analito como el patrn interno experimentan las mismas variaciones.
You might also like
- Determinación Potenciometrica de La Ácidez Del VinagreDocument20 pagesDeterminación Potenciometrica de La Ácidez Del VinagreJEAN CAMILO PORRAS RICONo ratings yet
- Nitracion de La AcetanilidaDocument13 pagesNitracion de La AcetanilidazanniazorzaNo ratings yet
- Equilibrio - Quimico UNAMDocument33 pagesEquilibrio - Quimico UNAMrbn.santiagoNo ratings yet
- Soluciones químicas ensayos caracterizaciónDocument4 pagesSoluciones químicas ensayos caracterizaciónWilfredo QuiñonesNo ratings yet
- Informe Alcalinidad y Acidez TotalDocument16 pagesInforme Alcalinidad y Acidez TotalLaauu KaasteellaanosNo ratings yet
- Informe 4Document5 pagesInforme 4Erick SalinasNo ratings yet
- Nomenclatura y reactividad de compuestos carbonílicosDocument65 pagesNomenclatura y reactividad de compuestos carbonílicosJCKARLNo ratings yet
- Cuadernillo de Problemas Quimica Analitica AplicadaDocument7 pagesCuadernillo de Problemas Quimica Analitica AplicadaBra. Dek100% (1)
- Cuestionario ComplexometriaDocument1 pageCuestionario ComplexometriaJhenny RosarioNo ratings yet
- Tarea Balance Sin Reacción QuímicaDocument5 pagesTarea Balance Sin Reacción QuímicaRomina Tapia MarcosNo ratings yet
- La Enzima Fosfofructuquinasa en Higado de AlpacaDocument5 pagesLa Enzima Fosfofructuquinasa en Higado de AlpacaEdita TorresNo ratings yet
- Práctica 6 Ácidos Carboxílicos-Síntesis de AspirinaDocument9 pagesPráctica 6 Ácidos Carboxílicos-Síntesis de AspirinaGabriela CastilloNo ratings yet
- IBIO 2415 Tarea1P2 - Transición de Fases AGDocument1 pageIBIO 2415 Tarea1P2 - Transición de Fases AGCarlos Israel Esparza AndradeNo ratings yet
- Guia Termodinamica 2015 PDFDocument132 pagesGuia Termodinamica 2015 PDFSimon MamaniNo ratings yet
- Formacion de CianhidrinasDocument4 pagesFormacion de CianhidrinasAron LopezNo ratings yet
- Practica 4 - Sintesis de AspirinaDocument4 pagesPractica 4 - Sintesis de AspirinaDiego PaúlNo ratings yet
- Gráfica Ley de HenryDocument1 pageGráfica Ley de Henrypaula avilaNo ratings yet
- Preinforme Practica 3Document1 pagePreinforme Practica 3fernanda oviedo50% (2)
- Cerveza Toma de Muestras GTC32Document0 pagesCerveza Toma de Muestras GTC32Leidys Yohanna GòmezNo ratings yet
- Laboratorio de Analisis Instrumental 4 - DETERMINACION DE HIERRODocument10 pagesLaboratorio de Analisis Instrumental 4 - DETERMINACION DE HIERROAntony Ramirez CamposNo ratings yet
- Ficha de Seguridad AGAR TSIDocument3 pagesFicha de Seguridad AGAR TSIJhon Boney QuembaNo ratings yet
- Análisis químico: Preparación de soluciones y cálculos analíticosDocument3 pagesAnálisis químico: Preparación de soluciones y cálculos analíticosMonica OramasNo ratings yet
- Bbme U1 EaDocument5 pagesBbme U1 EaLuis gallegosNo ratings yet
- 14.3 Considere Las Curvas para La Valoración de Naoh 0.10 MDocument1 page14.3 Considere Las Curvas para La Valoración de Naoh 0.10 MJEAN CAMILO PORRAS RICO0% (1)
- Ponchon Savarit PDFDocument41 pagesPonchon Savarit PDFMiguelAngelRodriguezTovarNo ratings yet
- Analitica EjerciciosDocument4 pagesAnalitica EjerciciosJuan GutierrezNo ratings yet
- Calibracion Multi Variable Modelo Directo Imprtante-1Document8 pagesCalibracion Multi Variable Modelo Directo Imprtante-1Emily Coromoto Gonzalez MarcanoNo ratings yet
- PolarografiaDocument7 pagesPolarografiaLoRelys VeGaNo ratings yet
- Determinación de Dureza en Agua2020Document3 pagesDeterminación de Dureza en Agua2020Fernanda Nieto UriosteguiNo ratings yet
- Problemas T15 - 14-01-2019Document6 pagesProblemas T15 - 14-01-2019Miguel Garcia0% (1)
- Voltamperometria HidrodinámicaDocument2 pagesVoltamperometria HidrodinámicaFlorwenciaGonzalezNo ratings yet
- Análisis de carbonatos y bicarbonatos por titulación pH-métricaDocument4 pagesAnálisis de carbonatos y bicarbonatos por titulación pH-métricaFranklin Pastrana ArteagaNo ratings yet
- Trabajo Final EIADocument86 pagesTrabajo Final EIALorenaRojasNo ratings yet
- Farmacos Como Mezclas RacemicasDocument31 pagesFarmacos Como Mezclas RacemicasIrvin Ramirez SalazarNo ratings yet
- Obj2. 61-86Document12 pagesObj2. 61-86jorgeNo ratings yet
- Taller 1 Balance Sin Reacción QuímicaDocument13 pagesTaller 1 Balance Sin Reacción QuímicaAna María Vallejo TorresNo ratings yet
- Determinación de Niquel en Una Sal o Aleacion (2020)Document4 pagesDeterminación de Niquel en Una Sal o Aleacion (2020)Helber Dario Melo FigueroaNo ratings yet
- Informe 7 FisicoquimicaDocument9 pagesInforme 7 FisicoquimicaDaniel KStilloNo ratings yet
- Acidobase ProblemasDocument7 pagesAcidobase ProblemasRobert OcrospomaNo ratings yet
- Determinación de % de Na2CO3 Por Titulacion - RetornoDocument3 pagesDeterminación de % de Na2CO3 Por Titulacion - RetornoDavid Hinostroza IbarraNo ratings yet
- Métodos para diagnóstico de parásitos en heces mediante análisis directo y cuantitativoDocument38 pagesMétodos para diagnóstico de parásitos en heces mediante análisis directo y cuantitativoJackeline MarinNo ratings yet
- Taller Procesos IndustrialesDocument11 pagesTaller Procesos IndustrialesSebastian HerreraNo ratings yet
- Sacarificacion y Fermentacion de La Cascara de TunaDocument107 pagesSacarificacion y Fermentacion de La Cascara de TunaJhonyF80No ratings yet
- Informe RefractometriaDocument4 pagesInforme Refractometriavalentina alzateNo ratings yet
- Clase 13 Ejercicios de Reacciones OrgánicasDocument5 pagesClase 13 Ejercicios de Reacciones OrgánicasJoelAnguianoNo ratings yet
- Cuántos Gramos de CuSO4Document4 pagesCuántos Gramos de CuSO4Richard Peña Alcca0% (1)
- ALUMBREDocument4 pagesALUMBREDiegoNo ratings yet
- Balances de Masa en Estado EstacionarioDocument43 pagesBalances de Masa en Estado EstacionarioJuan MonterrozaNo ratings yet
- Pruebas de Caracterización de Compuestos OrgánicosDocument5 pagesPruebas de Caracterización de Compuestos OrgánicosHarold Andrés LeónNo ratings yet
- Determinación de nitrógeno en quesos por KjeldahlDocument6 pagesDeterminación de nitrógeno en quesos por Kjeldahlgianella neyra rodriguezNo ratings yet
- Practica 11. Extracción de Ácidos Nucleicos A Partir de LevaduraDocument11 pagesPractica 11. Extracción de Ácidos Nucleicos A Partir de LevaduraDanna AnguloNo ratings yet
- 12 Síntesis, Separación e Identificación de Halogenuros de AlquiloDocument9 pages12 Síntesis, Separación e Identificación de Halogenuros de AlquiloAimeé Jimena Alfaro ReyesNo ratings yet
- Balance de Masa para La Deshidratación de Sólidos-1Document4 pagesBalance de Masa para La Deshidratación de Sólidos-1Edison OrtizNo ratings yet
- Experimento 10 PDFDocument5 pagesExperimento 10 PDFLuïz A. Pinto Jr.No ratings yet
- EX PARCIAL QU114 2005 2aDocument1 pageEX PARCIAL QU114 2005 2aLuis Fernando Chalco RamosNo ratings yet
- UDocument2 pagesURandyNo ratings yet
- Sintesis Extraccion y CCFDocument6 pagesSintesis Extraccion y CCFdavid romeroNo ratings yet
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaFrom EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaRating: 5 out of 5 stars5/5 (1)
- Equilibrio de fases: Un enfoque basado en competenciasFrom EverandEquilibrio de fases: Un enfoque basado en competenciasNo ratings yet
- TP SolucionesDocument7 pagesTP SolucionesJuanjo TrinkaNo ratings yet
- Ingeniería sismorresistente: Ejercicios de análisis modal y estáticoDocument19 pagesIngeniería sismorresistente: Ejercicios de análisis modal y estáticoLander Ernesto Cerda AlvaradoNo ratings yet
- 1371 2 Presion de ReposoDocument29 pages1371 2 Presion de ReposoMarco Antonio Vasquez LavadoNo ratings yet
- Qué Es Un Choque ElásticoDocument3 pagesQué Es Un Choque ElásticoAmerico WaxNo ratings yet
- Manual de NavegacionDocument40 pagesManual de NavegacionLupita Chavez MazaNo ratings yet
- Ley de Ampere y Biot-SavartDocument3 pagesLey de Ampere y Biot-SavartJose Cruz MichagaNo ratings yet
- EngranesDocument23 pagesEngranesPablo Zven MtzNo ratings yet
- Química Apuntes VariosDocument82 pagesQuímica Apuntes VariosLeslie EstNo ratings yet
- Especificaciones Técnicas CITEmaderaDocument124 pagesEspecificaciones Técnicas CITEmaderaArmando Nilo Ramos SilvaNo ratings yet
- Métodos de Estudio en HistologiaDocument9 pagesMétodos de Estudio en HistologiaAndres Medina Orosco0% (1)
- Reporte - Fuente 12 - 12 5 y RegulableDocument9 pagesReporte - Fuente 12 - 12 5 y RegulableSmuert Poot VazquezNo ratings yet
- Practica IndividualDocument2 pagesPractica IndividualGuillermina del Carmen Mendioola MartínezNo ratings yet
- Equilibrio de Un Solido RigidoDocument2 pagesEquilibrio de Un Solido RigidoMiguel AngelNo ratings yet
- Analisis en DC en La Primera EtapaDocument7 pagesAnalisis en DC en La Primera EtapaJose Elias Perafan LealNo ratings yet
- LarelaticdDocument22 pagesLarelaticdleandrole0% (1)
- Torsión MecánicaDocument62 pagesTorsión MecánicaLisinha MilagritosNo ratings yet
- ESPECIFICACIONESDocument62 pagesESPECIFICACIONESEdilberto José Roncallo BayueloNo ratings yet
- Marcha en Personas Amputadas de Miembro InferiorDocument73 pagesMarcha en Personas Amputadas de Miembro InferiorMelissa Osorio Romero100% (1)
- Materiales CompuestosDocument10 pagesMateriales CompuestosFausto CclNo ratings yet
- Lab de QuimicaDocument13 pagesLab de Quimicadocsofi60% (5)
- Calorimetrìa - CálculosDocument2 pagesCalorimetrìa - Cálculosluisa maderaNo ratings yet
- Prevencion Riesgos ElectricosDocument10 pagesPrevencion Riesgos ElectricosaysNo ratings yet
- Dyna'2017 (Simulacion Anhidro)Document9 pagesDyna'2017 (Simulacion Anhidro)Nathy QuiñonezNo ratings yet
- Tarea2 Fisica1Document2 pagesTarea2 Fisica1AngelAngelHernandez100% (4)
- Método de Cross para Marcos Sin Desplazamiento LateralDocument4 pagesMétodo de Cross para Marcos Sin Desplazamiento LateralBryanTaipe100% (1)
- Deheza Mec 2239 (2 Parcial)Document5 pagesDeheza Mec 2239 (2 Parcial)Rommel H. Deheza EspinozaNo ratings yet
- Sinus MDocument215 pagesSinus MYasuYantra123No ratings yet
- Cemento DentalDocument3 pagesCemento DentalÑañielaNo ratings yet
- Diseño de Un Satélite ArtificialDocument21 pagesDiseño de Un Satélite ArtificialCándidoNo ratings yet