Professional Documents
Culture Documents
Diseño Del Reactor Batch... Modulo
Uploaded by
Benjamin Daniel Mondargo CristobalOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Diseño Del Reactor Batch... Modulo
Uploaded by
Benjamin Daniel Mondargo CristobalCopyright:
Available Formats
UNIVERSIDAD NACIONAL DEL CENTRO DEL PER FACULTAD DE INGENIERA QUMICA
DEPARTAMENTO ACADMICO DE INGENIERA TEMA
DISEO DE UN REACTOR TIPO BATCH
Presentado al: Ing. Ms. SUASNABAR BUENDA, Hugo. Facilitador del curso 072 B REACCIONES QUMICAS Realizado por: MONDARGO CRISTOBAL, Benjamn Daniel OCHOA BRUNO, Lincoln. Alumnos del VII ciclo de Ingeniera Qumica HUANCAYO PERU 23-07-2012
INTRODUCCIN
Una de las tareas del ingeniero cuando est frente a una serie de operaciones que transforman ciertos insumos o materias primas mediante procesos fsicos y qumicos consiste en el dimensionamiento de los equipos correspondientes. En los casos en que se dan transformaciones qumicas (o bioqumicas) de la materia, el corazn del proceso se da en el reactor qumico. Para disear un reactor debe contestarse una serie de preguntas tales como: qu tipo de equipo se necesita para lograr la extensin de la reaccin requerida? Qu condiciones de operacin (temperaturas, presin, velocidades de flujo) se necesitan? La respuesta a estas cuestiones constituye el diseo del proceso del reactor. El diseo de un rector implica la determinacin del tamao del recipiente necesario para obtener la cantidad especificada de producto y evaluar la temperatura, presin y composicin de la mezcla reaccionante (condiciones de operacin) en varias partes del equipo. Para lograr esto es necesario conocer las condiciones de entrada al reactor, tales como temperatura, presin y la composicin de los reactantes, as como conocer el mtodo de operacin del reactor, es decir, si en un reactor que se maneje por lotes separados, si es continuo, isotrmico o adiabtico, etc. Los balances de masa y de energa en un reactor proporcionan las bases para relacionar la velocidad de produccin y la composicin de los productos con la velocidad de reaccin qumica. Para este trabajo de aplicacin todas las variables a estudiar que se hace son bsicamente para un reactor ideal intermitente o tambin llamado reactor discontinuo tipo batch, estos reactores raras veces son utilizados a escala comercial para reacciones gaseosas, debido a que la cantidad de producto obtenido en el reactor es pequea. Estos reactores son utilizados ms en reacciones lquidas y son sencillos de operar e industrialmente, se utilizan cuando se han de tratar pequeas cantidades de sustancias.
OBJETIVOS
GENERAL: Conocer los principios bsicos del diseo del reactor para determinar el tamao del reactor, alimentacin y composicin.
ESPECFICOS: Evaluar las Condiciones de operacin de presin y temperatura. Determinar las conversiones necesarias haciendo uso de la estequiometra Evaluar el tiempo necesario para obtener una conversin ptima.
REACTOR DISCONTINUO IDEAL (Reactor tipo batch)
1. PRINCIPIOS TERICOS. En un reactor discontinuo ideal no hay entrada ni salida de reactante. Se supone adems que el reactor est perfectamente agitado, esto es, que la composicin es la misma en todos los puntos del reactor para un instante de tiempo dado. Las ventajas del reactor mienten con su flexibilidad. Un solo recipiente puede realizar una secuencia de diversas operaciones sin la necesidad de romper la contencin. Esto es particularmente til se procesan txicos o componentes altamente potentes. 1.1. Modo de operacin en el reactor tipo batch. El reactor es alimentado por el tope del tanque. Mientras la reaccin es llevada a cabo nada es agregado o removido. El tanque es fcilmente calentado o enfriado por una chaqueta. Utilizados en pequea escala (farmacutica, fermentacin).
Fig. 1 . Reactor tipo batch A pesar de que estos reactores son muy usados en procesos industriales y aplicaciones de control de contaminacin, para el tratamiento de aguas residuales son poco prcticos pues se necesita tener entrada y salida de agua para que se pueda tratar volmenes de agua residual considerables. 1.2. Ecuacin de diseo de un reactor discontinuo. Al suponer mezcla perfecta, la composicin se puede considerar uniforme en todo el reactor, por lo que realizando un balance de materia para cualquier reaccionante, se tiene:
[ENTRADA] - [SALIDA] - [REACCION] = [ACUMULACION]
En este caso concreto, al no existir entrada ni salida, la ecuacin anterior se simplifica a:
[REACCION] = [ACUMULACION] [REACCION] = (rA)*V
Donde: NAo= moles iniciales de reaccionante A. XA= conversin del reaccionante A. V= volumen del reactor. (-rA)=velocidad de desaparicin del reaccionante A. Sustituyendo la ecuacin inicial:
Separando variables e integrando se obtiene:
La integracin de esta ecuacin permite el tiempo necesario para que alcance una conversin determinada (XA) en condiciones isotrmicas. 1.3. Ventajas Alta conversin por unidad de volumen. Flexible. El mismo reactor puede ser utilizado para producir diferentes productos. Fcil de limpiar. Desventajas Altos costos de operacin. La calidad del producto es ms variable que con los reactores de operacin continua.
1.4.
1.5.
Tiempo de residencia:
B = + t Donde: = tiempo de descarga, la limpieza, etc. T tiempo de reaccin.
1.6.
Volumen de un reactor:
V=mt/m Donde: V= volumen del reactor. mt = masa total. m =Densidad de la mezcla.
1.7.
Volumen real:
VR= V+0.1*V=1.1*V
2. CINTICA DE LAS REACCIONES HOMOGNEAS En las reacciones homogneas todas las sustancias reaccionantes se encuentran en una sola fase: gaseosa o lquida, en general. Supngase que se tiene cierta reaccin qumica homognea en la que dos sustancias A y B (reactivos) reaccionan para dar ciertos productos R y S: A + bB rR + Ss La ecuacin estequiomtrica dice que un mol de A reacciona con b moles de B para producir r moles de R y s moles de S. Para definir la velocidad de reaccin debemos precisar primero respecto a cul de todas las sustancias se refiere, por ejemplo respecto al reactivo A. La velocidad de reaccin se define entonces como la variacin de moles de A en el tiempo. Como conviene definir la velocidad de reaccin de manera intensiva se refiere esa variacin al volumen de reaccin:
De acuerdo a esta definicin la velocidad de reaccin de un reactivo (velocidad de desaparicin) es positiva. Si rA se definiera respecto a un producto (velocidad de formacin) la expresin no incluye el signo de menos a los efectos de que la expresin quede positiva.
En sistemas homogneos la velocidad de reaccin depende de la composicin de las sustancias en la fase considerada, as como de la temperatura y presin del sistema (esta ltima variable en los sistemas gaseosos). No obstante, dichas variables son interdependientes, en el sentido de que la presin queda determinada dada la temperatura y la composicin de la fase. En consecuencia se puede escribir la siguiente ecuacin cintica: rA = f (temperatura, composicin) En muchas reacciones se puede encontrar una expresin para la velocidad de reaccin que est constituida por dos factores: uno dependiente exclusivamente de la concentracin y otro dependiente exclusivamente de la temperatura. Si se trabaja en condiciones isotrmicas rA = k * f (composicin) Donde k se denomina constante cintica de la reaccin. En muchas oportunidades el trmino que depende de la composicin de la mezcla puede sustituirse por una expresin del tipo. rA = k CAa CBb ....CDd , a + b + .... + d = n
Donde Ci es la concentracin (masa por unidad de volumen) de la sustancia i, donde i = A, B,...., D son las sustancias que intervienen en la reaccin. Los coeficientes a los cuales estn elevados las concentraciones se denominan rdenes de reaccin, esto es, a es el orden de reaccin con respecto al reactivo A, b el orden de reaccin de B, etc., siendo n el orden global de reaccin. En las reacciones elementales ocurren colisiones o interacciones de las sustancias reaccionantes a nivel molecular que se dan en un solo paso. Por lo tanto, a una temperatura dada, la velocidad de reaccin es proporcional a la concentracin de los reactantes. Por ejemplo, para una reaccin elemental A+ B R la expresin de la ecuacin cintica ser rA = k CA*CB . Sin embargo, una reaccin que responda a una expresin cintica como la anterior puede no ser elemental. Las reacciones no elementales pueden tener expresiones cinticas que no se correspondan con la estequiometra, pues en realidad son el resultado final de una serie de pasos (estos si elementales). Su expresin final, que puede llegar a ser relativamente compleja, deber determinarse experimentalmente y eventualmente recurriendo a la verificacin de algn modelo de mecanismo de reaccin. Ciertas reacciones no son irreversibles sino que dado el suficiente tiempo se llegar a un estado de equilibrio entre reactivos y productos.
Muchas de estas reacciones reversibles pueden considerarse como una combinacin de dos reacciones elementales, una en sentido directo y otra en sentido inverso: A + B R + S La velocidad de desaparicin de A por la reaccin directa est dada por: rA directa = k1CACB Y la velocidad de formacin por la reaccin inversa est dada por: rA inversa = k2CRCS En el equilibrio la velocidad de desaparicin es igual a la velocidad de formacin por lo que: k1CACB |equilibrio = k2CRCS |equilibrio
Donde Keq es la constante de equilibrio para esta reaccin reversible compuesta por dos reacciones elementales. (La constante de equilibrio est relacionada tambin con variables termodinmicas: G o = - RT lnK, donde Go es la variacin de energa libre en la reaccin, R es la constante de los gases y T la temperatura absoluta). 2.1. AVANCE DE REACCIN. Distintos parmetros pueden utilizarse para medir el avance de una reaccin pero uno de los ms usados es la conversin, esto es la fraccin de reactivo que ya ha reaccionado. Por ejemplo, supongamos que en un recipiente cerrado est ocurriendo la reaccin. A productos Y se parti de un nmero inicial de moles de A que llamaremos NAo . Al cabo de cierto tiempo de reaccin la cantidad de moles habr disminuido a cierto nmero NA . La conversin de A (que anotamos XA) queda definida por:
Esta definicin es vlida para los sistemas en discontinuo o batch. Para los sistemas en flujo continuo la conversin se define en funcin de los flujos molares (moles por unidad de tiempo):
Donde FAo es el flujo molar a la entrada del sistema y FA el flujo molar a la salida, o en algn otro punto del sistema. Estas definiciones nos permiten trabajar con la variable conversin en lugar de trabajar con nmero de moles, o flujos molares, o incluso en muchos casos concentraciones, pues para sistemas en discontinuo.
Y para los sistemas en flujo.
Como el flujo molar es igual al producto de la concentracin por el flujo volumtrico FA = v.CA [moles/s] en los casos en que el caudal no sufre expansin ni contraccin dentro del reactor, como por ejemplo cuando se trata de un lquido, CA = CAo (1 XA) . En el marco en el que se desarrolla este curso, las aplicaciones prcticas normalmente se referirn a corrientes con densidad constante (p.ej. lquidos) por lo que la ltima expresin ser ampliamente utilizada. Muchas veces aparece como definicin de velocidad de reaccin la siguiente expresin:
Estrictamente hablando, la expresin anterior no debe tomarse como una definicin de velocidad de reaccin, ya que en realidad se trata de una expresin vlida solo en sistemas discontinuos, como se ver ms adelante. Los sistemas en flujo se disean normalmente en estado estacionario y en esas condiciones no existe variacin en el tiempo de las variables de estado, no tiene sentido hablar de una diferencial respecto al tiempo.
2.2.
MTODO INTEGRAL DE ANLISIS DE DATOS En el mtodo integral de anlisis de datos se ensaya una ecuacin cintica particular, se integra y se comparan los datos calculados para cada tiempo t con los datos experimentales. Si el ajuste no es satisfactorio se sugiere y ensaya otra ecuacin cintica. Por ejemplo si se tiene una reaccin A productos en un sistema discontinuo de volumen constante la expresin cintica ser como hemos dicho.
O en el caso menos general en que puedan separarse los trminos dependientes de la concentracin de los no dependientes.
Esta ecuacin puede integrarse segn
De acuerdo con esto una representacin del trmino de la izquierda frente al tiempo conduce a una recta de pendiente k. A partir de los datos experimentales y suponiendo una determinada forma para f (CA) se calcula entonces el trmino de la integral y se representa frente a los tiempos correspondientes. Se observa si estos datos se distribuyen sobre una recta que pasa por el origen. En caso afirmativo se puede decir que la ecuacin cintica ensayada se ajusta a los datos experimentales. En caso negativo es necesario ensayar otra ecuacin. 2.3. MTODO DIFERENCIAL DE ANLISIS DE DATOS En el mtodo diferencial se emplea directamente la ecuacin diferencial a ensayar: se evalan todos los trminos de la ecuacin, incluida la derivada dCA/dt y se ensaya la bondad del ajuste de la ecuacin con los datos experimentales. Supongamos que tenemos como en el caso anterior
A partir de las experiencias se obtienen los datos concentracin-tiempo y se representan grficamente. Se traza la curva continua ajustada a los puntos presentados. Se determinan las pendientes de esta curva, que son las velocidades de reaccin dCA/dt . Se evala f(CA) para cada concentracin. Se representa -ln (dCA/dt) frente a ln(CA). Si se obtiene una recta el procedimiento estuvo correctamente realizado, la pendiente de esa curva es el orden de reaccin y la ordenada en el origen nos da la constante cintica. El error ms importante de este mtodo es la evaluacin grfica de las pendientes, aunque tiene la ventaja frente al anterior que no es necesario presuponer un orden de reaccin. 2.4. MTODO DE LAS VELOCIDADES INICIALES En este caso se hace una serie de experiencias de CA frente a t, para diferentes condiciones iniciales y cada experiencia se extrapola hasta condiciones iniciales para hallar la velocidad inicial de reaccin (tangente de la curva CA vs t a t = 0). Despus se grafican las distintas velocidades iniciales frente a las distintas concentraciones iniciales obtenindose, como en el caso anterior, una recta cuya pendiente nos da el orden de reaccin y cuya ordenada en el origen nos da la constante cintica. 2.5. OTRAS ALTERNATIVAS PARA EL TRATAMIENTO DE LOS DATOS Una variacin de los mtodos anteriores es el mtodo del tiempo medio. Supongamos que tenemos una reaccin del tipo:
Integrando para n 1, da:
Definiendo t1/2 como el tiempo necesario para que la concentracin de los reactantes descienda a la mitad de su valor inicial resulta:
Y graficando ln(t1/2) frente a ln(CAo) dar una recta de pendiente 1 n . En ciertas ocasiones la expresin cintica no es tan sencilla de trabajar, pues no responde a la forma rA = k*CAn , y no son directamente aplicables los mtodos anteriores. Un caso muy frecuente es el siguiente
A cuyo formato responden la cintica enzimtica de Michaelis-Menten o la de crecimiento microbiano de Monod. Haciendo un pequeo reordenamiento de los trminos es posible lograr una expresin lineal. As por ejemplo tomando la recproca.
Y representando 1/rA frente a 1/CA se obtiene una recta de pendiente 1/k1 y ordenada en el origen k2/k1. Otra forma de linealizar la ecuacin es la siguiente:
Y graficar rA frente a rA/CA. Otro tipo de expresiones que dependen de varios reactivos, con expresiones del tipo:
Se trabajan con el mtodo de componentes en exceso, esto es, se mantiene la concentracin de todos los dems componentes menos el estudiado en exceso suficiente como para que su variacin sea despreciable con el avance de la reaccin: Y se trabaja entonces utilizando los mtodos vistos ms arriba.
APLICACIN PARA EL DISEO DE UN REACTOR TIPO BATCH
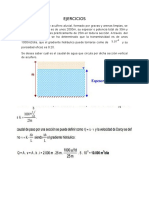
(Del ejercicio N 4 de problemas propuestos del curso re reacciones qumicas I). Hemos diseado un reactor que cumpla con los siguientes procedimientos a seguir. Tenemos una reaccin reversible que se trata del: H 2SO4 y NaOH y se desea obtener su mxima conversin del reactivo limitante. Que al principio ambos compuestos contienen la misma concentracin 12 M. De datos bibliogrficos: Los valores de: k1 = 19*10-3 L2/molg2.min. k2 = 4*10-4L2/molg2.min. Las condiciones de operacin son a presin constante y temperatura constante. a. Cul ser su mxima conversin en el equilibrio? b. En que tiempo se logra obtener la mxima conversin? c. Luego calcular el volumen del reactor para tal reaccin. PROCEDIMIENTO PARA EL CLCULO DEL REACTOR TIPO BATCH. Primero nos planteamos la ecuacin de la reaccin, tal ecuacin es:
H2SO4
+ 2NaOHNa2SO4 + 2H2O
2B B R + 2S 1/2R + S
Podemos representar de esta forma:
A 1/2A
+ +
Llevando a su forma mnimo de balance:
Entonces las velocidades de cada componente sern:
Como las concentraciones iniciales son 12M para ambos, entonces podemos identificar el reactivo limitante, en este caso se trata del NaOH. Seguimos el procedimiento. Clculo de concentraciones finales de cada compuesto en el equilibrio: CA=CAo - 1/2CBo.X CB=CBo - CBo.X CR=CRo + 1/2CBo.X CS=CSo + CBo.X Tambin sabemos que las unidades de k 1 y k2 son L2/molg2.min. Por tanto se dice que la reaccin es de orden 3. Entonces la velocidad ser: r = k1(A) (B) 2 - k2(R) (S)2 La mxima conversin en el equilibrio ser cuando r=0. 0= k1(A) (B) 2 - k2(R) (S)2
Mediante clculos se obtiene X= Xe = 0.885 Por tanto se dice que la conversin en el equilibrio es del 88.5% Rpta. Calculamos las concentraciones finales de los compuestos: CA = CAo - 1/2CBo.X CB = CBo - CBo.X CR = CRo + 1/2CBo.X CS = CSo + CBo.X CA = 6.69 M CB = 1.38 M CR = 5.31 M CS = 10.62 M
Determinando el tiempo, a su conversin mxima: Usando la ecuacin: r = k1(A) (B) 2 - k2(R) (S)2 = Se determina la velocidad de reaccin:
- 2(dCA/dt)
Rpta. Clculo del volumen del reactor: Por conceptos bibliogrficos: PM: H2SO4 = 98 PM: NaOH = 40 Se tiene la reaccin: H2SO4 V=mt/m
+ 2NaOHNa2SO4 + 2H2O
Y las concentraciones de cada reactivo esta hecho en 1 L. Vtot= 2L Determinados las masas de cada reactivo:
BIBLIOGRAFA
[1]http://www.galeon.com/hamd/pdf/reactorquimico.pdf [2]http://www.fing.edu.uy/iq/maestrias/DisenioReactores/materiales/notas1.pdf [3]http://catarina.udlap.mx/u_dl_a/tales/documentos/lic/munoz_c_r/capitulo3.pdf [4]http://www.mty.itesm.mx/dia/deptos/iq/iq95-872/Reactores/Clase6_2003.pdf [5]http://webdelprofesor.ula.ve/ingenieria/moira/clases/clase1 [6]http://diposit.ub.edu/dspace/bitstream/2445/12703/1/APUNTS%20DE %20REACTORS%20QU%C3%8DMICS.pdf
You might also like
- PAE-diabetes MellitusDocument23 pagesPAE-diabetes MellitusZerimar Zp50% (2)
- Manual de Operaciones RSW - Olga PDFDocument55 pagesManual de Operaciones RSW - Olga PDFEDRUG83% (6)
- Columnas de Rectificacion 23Document25 pagesColumnas de Rectificacion 23Rodrigo Salinas HuamancondorNo ratings yet
- Agitación y mezclado de fluidosDocument32 pagesAgitación y mezclado de fluidosAlejandro Josue Leon MedinaNo ratings yet
- Cuestionario BalanceDocument2 pagesCuestionario BalanceJuanLopezTrujilloNo ratings yet
- IQUI-2010-232 Simulacion de ProcesosDocument9 pagesIQUI-2010-232 Simulacion de ProcesosCarlos CortesNo ratings yet
- Transferencia de Masa Por Pared HumedaDocument8 pagesTransferencia de Masa Por Pared HumedaNallely HernandezNo ratings yet
- Preparación de Catalizadores Sólidos - 4IM65 - CPJG - GOJPDocument27 pagesPreparación de Catalizadores Sólidos - 4IM65 - CPJG - GOJPJessica G. Castro PreciadoNo ratings yet
- Destilación - Ejercicios ResueltosDocument39 pagesDestilación - Ejercicios Resueltosjavier gago100% (1)
- EJERCICIOS + PolymathDocument4 pagesEJERCICIOS + PolymathJhoel Jhonatan Busso DueñasNo ratings yet
- Sistemas ResumenDocument12 pagesSistemas ResumenMayte FarinangoNo ratings yet
- SOULI+ë DE MORANT, GEORGE - Compendio de La Verdadera Acupuntura ChinaDocument152 pagesSOULI+ë DE MORANT, GEORGE - Compendio de La Verdadera Acupuntura ChinaAnderson AlexandreNo ratings yet
- Metodo Ponchon-SavaritDocument10 pagesMetodo Ponchon-SavaritJavier De Los Santos Trinidad100% (1)
- Tabla estequiometria y sensibilidad reacción etileno-bromuro de hidrógenoDocument2 pagesTabla estequiometria y sensibilidad reacción etileno-bromuro de hidrógenoEdgar Gabriel OrtizNo ratings yet
- Primera Serie de Problemas Ingenieria de ReactoresDocument14 pagesPrimera Serie de Problemas Ingenieria de ReactoresivancuetoNo ratings yet
- TESISDocument83 pagesTESISBenjamin Daniel Mondargo Cristobal100% (2)
- Reactores Batch: diseño y variables claveDocument5 pagesReactores Batch: diseño y variables claveHLNTNo ratings yet
- HIDROISOMERIZACION DE n-PARAFINAS CONDocument12 pagesHIDROISOMERIZACION DE n-PARAFINAS CONErik Said Laiho0% (1)
- Dti Acido AceticoDocument6 pagesDti Acido AceticoLizbeth Gonzalez HernandezNo ratings yet
- Practica 7Document4 pagesPractica 7Anna EsquivelNo ratings yet
- Reporte 4 de Laboratorio de Ingeniería Química 4Document7 pagesReporte 4 de Laboratorio de Ingeniería Química 4Lenin Abraxas RNo ratings yet
- Problemas Rtac 2019081210Document12 pagesProblemas Rtac 2019081210Rodrigo DalenceNo ratings yet
- Clase Absorcion PDFDocument65 pagesClase Absorcion PDFEyvind Andres Rondon RinconNo ratings yet
- Cambiadores de Calor de Camisa y SerpentínDocument15 pagesCambiadores de Calor de Camisa y Serpentínmonica jimenezNo ratings yet
- Problema-Final 1Document7 pagesProblema-Final 1Grecia Alejandra Ramirez RicoNo ratings yet
- Modelo de Dispersión AxialDocument3 pagesModelo de Dispersión AxialClari Esquivel100% (1)
- Teoría Reactor PBRDocument5 pagesTeoría Reactor PBRMartín Sánchez GonzálezNo ratings yet
- OU-Parcial IIDocument2 pagesOU-Parcial IIFelipe RojasNo ratings yet
- Ej 13-3Document5 pagesEj 13-3Fernanda SalazarNo ratings yet
- Proyecto 1er Bimestre AspirinaDocument11 pagesProyecto 1er Bimestre Aspirinahenry quingatuñaNo ratings yet
- Transferencia de Masa Entre FasesDocument37 pagesTransferencia de Masa Entre Faseseduardo sharini muñoz equihuaNo ratings yet
- Reactores No IsotermicosDocument91 pagesReactores No Isotermicosabigael riveraNo ratings yet
- L5 SecadoDocument5 pagesL5 SecadoLaura Martinez0% (1)
- Instituto Tecnológico Superior de CoatzacoalcosDocument34 pagesInstituto Tecnológico Superior de CoatzacoalcosIsaac Coba GomezNo ratings yet
- Microsoft PowerPoint - Problemas Resuelt PDFDocument6 pagesMicrosoft PowerPoint - Problemas Resuelt PDFMarckos Ramos AbadNo ratings yet
- Compilación Heurísticos SIDocument18 pagesCompilación Heurísticos SIDennis Guillen MoyaNo ratings yet
- Conducción bidimensional numéricaDocument2 pagesConducción bidimensional numéricaHolaSoy AngeloNo ratings yet
- 5.2 Fluidizacion PDFDocument22 pages5.2 Fluidizacion PDFLucero Chontal Estudillo100% (1)
- Coordenadas libres de soluto y balances en operaciones unitariasDocument8 pagesCoordenadas libres de soluto y balances en operaciones unitariasveronica RodriguezNo ratings yet
- Practica 3)Document17 pagesPractica 3)Edgar MoralesNo ratings yet
- Eteres y EpóxidosDocument27 pagesEteres y EpóxidosKelvin JimenezNo ratings yet
- Ejercicios Del Punto de Pliegue PDFDocument2 pagesEjercicios Del Punto de Pliegue PDFGilbert Rodriguez PalmaNo ratings yet
- Tiempo de ResidenciaDocument26 pagesTiempo de ResidenciaChristopherElPadrinoCardenasNo ratings yet
- Ion Continua. Practica 2Document27 pagesIon Continua. Practica 2yaisfpNo ratings yet
- Seleccion Del Reactor IDocument29 pagesSeleccion Del Reactor IWalter NolascoNo ratings yet
- Formulario ReaccionesDocument4 pagesFormulario ReaccionesRicardo Bermeo MolinaNo ratings yet
- Determinación de Las Ecuaciones de Velocidad en ReaccionesDocument5 pagesDeterminación de Las Ecuaciones de Velocidad en ReaccionesOscar de la VegaNo ratings yet
- PracticiaDocument12 pagesPracticiaLuisAntonioDavilaZuñiga0% (1)
- Practica F7 Equipo 6Document9 pagesPractica F7 Equipo 6stephanieNo ratings yet
- 1.2 Desarrollo de Diagramas de FlujoDocument2 pages1.2 Desarrollo de Diagramas de FlujoChristian Serna TerronesNo ratings yet
- Diseño y Construcción de Un Prototipo de Reactor Tipo BatchDocument3 pagesDiseño y Construcción de Un Prototipo de Reactor Tipo BatchSolangeRojasNo ratings yet
- Práctica 9.Document9 pagesPráctica 9.angel BenavidesNo ratings yet
- R2 Reactor Por LotesDocument20 pagesR2 Reactor Por LotesJose Antonio VazquezNo ratings yet
- DESORCION PDF PDFDocument22 pagesDESORCION PDF PDFRicardo Espinoza SarmientoNo ratings yet
- Previo 3 CSTRDocument7 pagesPrevio 3 CSTRNataliSotoRojasNo ratings yet
- HARINAS DE MINATITlANDocument14 pagesHARINAS DE MINATITlANWILBER DE JESUS TORRES TORRESNo ratings yet
- Diseño y Exactitud Del Método de Gota PendienteDocument15 pagesDiseño y Exactitud Del Método de Gota PendienteEdgar V. AlvaradoNo ratings yet
- Wankat 4D33Document15 pagesWankat 4D33MaruriNo ratings yet
- Problemas Resueltos de MetalurgiaDocument5 pagesProblemas Resueltos de MetalurgiaJoseNo ratings yet
- Práctica 13. Determinación de Eficiencia de Un Filtro PrensaDocument5 pagesPráctica 13. Determinación de Eficiencia de Un Filtro PrensaItzel Daniela Solis TinocoNo ratings yet
- Diseño y análisis de la velocidad total en un reactor Trickle Bed heterogéneo catalíticoDocument9 pagesDiseño y análisis de la velocidad total en un reactor Trickle Bed heterogéneo catalíticoRandyNo ratings yet
- DISEÑO DE REACTORES TallerDocument11 pagesDISEÑO DE REACTORES TallerdiegogodieNo ratings yet
- PROYECTODocument26 pagesPROYECTOKJTEJNo ratings yet
- Reactor Tanque Continio (Sabrina)Document39 pagesReactor Tanque Continio (Sabrina)Nathaly SantosNo ratings yet
- Exposicion de Reaccion #2Document14 pagesExposicion de Reaccion #2Jair OñateNo ratings yet
- Tesis 1-2Document13 pagesTesis 1-2Benjamin Daniel Mondargo CristobalNo ratings yet
- Diseño de Un Reactor de Manto de Lodo Anaerobio de Flujo Ascendente (Uasb) A Nivel de LaboratorioDocument97 pagesDiseño de Un Reactor de Manto de Lodo Anaerobio de Flujo Ascendente (Uasb) A Nivel de LaboratorioBenjamin Daniel Mondargo Cristobal100% (1)
- 5430858M285 PDFDocument77 pages5430858M285 PDFAlejandro ParejaNo ratings yet
- Dinamica ProcesosDocument61 pagesDinamica ProcesosBenjamin Daniel Mondargo CristobalNo ratings yet
- Tratamiento de Aguas ResidualesDocument53 pagesTratamiento de Aguas ResidualesBenjamin Daniel Mondargo CristobalNo ratings yet
- FamerDocument1 pageFamerBenjamin Daniel Mondargo CristobalNo ratings yet
- Tesis de Biogas Mondargo y RomaniDocument56 pagesTesis de Biogas Mondargo y RomaniBenjamin Daniel Mondargo CristobalNo ratings yet
- Plan de Negocio de La Empresa DnaturaDocument31 pagesPlan de Negocio de La Empresa DnaturaBenjamin Daniel Mondargo Cristobal100% (5)
- Info Masa Difussion MDocument60 pagesInfo Masa Difussion MBenjamin Daniel Mondargo CristobalNo ratings yet
- Sifon Del Grupo Bien HechoDocument22 pagesSifon Del Grupo Bien HechoBenjamin Daniel Mondargo Cristobal0% (1)
- Plan de Negocio de La Empresa Dnatura (Autoguardado)Document64 pagesPlan de Negocio de La Empresa Dnatura (Autoguardado)Benjamin Daniel Mondargo CristobalNo ratings yet
- Plan de Negocio de La Empresa DnaturaDocument31 pagesPlan de Negocio de La Empresa DnaturaBenjamin Daniel Mondargo Cristobal100% (5)
- Regiones NaturalesDocument12 pagesRegiones NaturalesValeria Leon Rodriguez100% (1)
- Teoría, género y ciencia ficciónDocument17 pagesTeoría, género y ciencia ficciónMorganitaSurrealismeNo ratings yet
- Codecs PDFDocument17 pagesCodecs PDFEmil KamadaNo ratings yet
- ComicDocument36 pagesComicRushian Sarai AmbrosioNo ratings yet
- Formación de Cristales de Azúcar en El Proceso de Licores EscarchadosDocument2 pagesFormación de Cristales de Azúcar en El Proceso de Licores EscarchadosMartin TowersNo ratings yet
- CRISTONAUTASDocument38 pagesCRISTONAUTASJorge Armando Rojas RangelNo ratings yet
- HomeGlide Manua de UsuarioDocument25 pagesHomeGlide Manua de UsuarioCreaciones Vilber0% (1)
- Act 16Document5 pagesAct 16Keissy Ivette Sandoval GonzálezNo ratings yet
- HOMÓNIMOSDocument3 pagesHOMÓNIMOSJack Brothers100% (1)
- Generalidades de Los Pulmones y ToraxDocument7 pagesGeneralidades de Los Pulmones y ToraxXitlalyEsparzaNo ratings yet
- EVALUACIÓN FORMATIVA INICIAL DIAGNÓSTICA, INTRODUCCIÓN A LA PSICOPEDAGOGÍA, Año 2022.Document4 pagesEVALUACIÓN FORMATIVA INICIAL DIAGNÓSTICA, INTRODUCCIÓN A LA PSICOPEDAGOGÍA, Año 2022.María José VegaNo ratings yet
- Sistemas de inecuaciones para resolver problemas de transporte, ventas y fabricaciónDocument1 pageSistemas de inecuaciones para resolver problemas de transporte, ventas y fabricaciónNicolás FuenteNo ratings yet
- Diseño de Una Planta Deshidratadora de Banano Usando Secador de Gabinetes para La Producción de HarinaDocument6 pagesDiseño de Una Planta Deshidratadora de Banano Usando Secador de Gabinetes para La Producción de HarinajuniorNo ratings yet
- DUREZA VickersDocument3 pagesDUREZA VickersPiero MehNo ratings yet
- Dirección como proceso administrativoDocument14 pagesDirección como proceso administrativoJuan Pa MartinezNo ratings yet
- CromatinaDocument17 pagesCromatinaAnthony TenezacaNo ratings yet
- Biografía Philip KotlerDocument7 pagesBiografía Philip KotlersebastianNo ratings yet
- Reacciones transfusionales: clasificación e incidenciaDocument29 pagesReacciones transfusionales: clasificación e incidenciaZtharquencithap Dizck FuchirruminaNo ratings yet
- Filosof+¡a, Qu+® Es Eso. SAVATER. Hist. Filos.Document5 pagesFilosof+¡a, Qu+® Es Eso. SAVATER. Hist. Filos.Gonzalo DiazNo ratings yet
- Explicamos El Rol de Los Actores Sociales en La Producción Y Consumo de Alimemtos NativosDocument2 pagesExplicamos El Rol de Los Actores Sociales en La Producción Y Consumo de Alimemtos NativosAdriano ChapoñanNo ratings yet
- Texto DocentearDocument2 pagesTexto DocentearInti A. GarberNo ratings yet
- Formato Asignación Inicial de La Carga AcadémicaDocument10 pagesFormato Asignación Inicial de La Carga AcadémicaJuan Esteban Arevalo VergelNo ratings yet
- Tema 16 Los Viajes Del AprendizDocument2 pagesTema 16 Los Viajes Del AprendizAlberto Salmeron LizaldiNo ratings yet
- 3 El Lenguaje en La MedicinaDocument4 pages3 El Lenguaje en La MedicinaDerrardja YounesNo ratings yet
- Eca 5º .....Document11 pagesEca 5º .....Jeni AragundyNo ratings yet
- Nuevo Documento de Microsoft WordDocument3 pagesNuevo Documento de Microsoft WordDanny Kiqui EscamillaNo ratings yet