Professional Documents
Culture Documents
A1247 1 Problemas Modelo Tema 3
Uploaded by
MonconeOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
A1247 1 Problemas Modelo Tema 3
Uploaded by
MonconeCopyright:
Available Formats
QUMICA 2 BACHILLERATO
M. Angulo
Tema 3
UNIN ENTRE TOMOS. TIPOS DE
ENLACES
CRITERIOS DE EVALUACIN CUESTIONES Y PROBLEMAS
Explicar por qu los tomos se unen para
formar compuestos qumicos
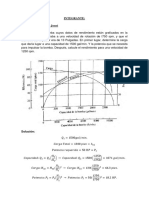
1. Las curvas de energa para la formacin del Rn
2
, H
2
y E
2
vienen representadas
en la siguiente figura.
a) Existen todos los compuestos indicados?
b) Cul de los que se forman es ms estable? Por qu?
c) Cul de los formados posee mayor longitud de enlace? Por qu?
Conocer la naturaleza de los enlaces
inico y metlico
2. El nmero atmico Z de un elemento A es 17 y el de otro elemento B es 38.
a) Escribe la configuracin electrnica de cada elemento e indica el grupo y el
perodo al que pertenecen.
b) J ustifica el tipo de enlace que formarn entre ellos. Nombra y formula el
posible compuesto.
c) Indica las propiedades generales que presentan este tipo de compuestos.
Entender el concepto de energa reticular
y realizar clculos de energas de los
procesos implicados en la formacin
del enlace inico mediante el ciclo de
Born-Haber
3. El LiF y KCI: -
a) Qu tienen en comn?
b) Cul de los dos compuestos tiene mayor punto de fusin? Por qu?
c) Cul de ellos tendr mayor dureza? Por qu?
d) Cul de ellos ser ms soluble en agua? Por qu?
4. A partir de los datos que se dan a continuacin calcula la afinidad electrnica
del tomo de yodo gaseoso. Utiliza para ello un ciclo de Born-Haber.
Datos: Calor estndar de formacin del Kl (s) =-327 kJ mol
-1
Calor de sublimacin del K (s)= 90 kJ mol
-1
Calor sublimacin del I
2
(s) =62 kJ mol
-1
Energa de disociacin del I
2
(g) =149 kJ mol
-1
Energa de ionizacin del K (g)= 418 kJ mol
-1
Energa reticular del KI(s) =633 kJ mol
-1
Conocer las propiedades generales que
presentan los compuestos inicos y
metlicos. Identificar estos compuestos
por sus propiedades
5. Completa la siguiente tabla:
Sustancia Fe NaCl
Tipo de enlace
Estado de agregacin
(25 C y 1 atm)
Solubilidad en agua
Solubilidad en
disolventes polares
Conductividad
E(kJmol
-1
)
QUMICA 2 BACHILLERATO
M. Angulo
Tema 3
(segunda parte)
EL ENLACE COVALENTE
CRITERIOS DE EVALUACIN CUESTIONES Y PROBLEMAS
Comprender la naturaleza del enlace
covalente y conocer las distintas teoras
que lo explican.
1. Si la energa para romper un enlace simple CC es de 348 kJ /mol, la de un
enlace CC ser el doble? Razona tu respuesta apoyndote en la teora del enlace
de valencia (TEV).
2. Dados los tomos
8
A,
17
B y
11
C:
a) Indica el grupo y el perodo a los que pertenecen cada uno.
b) Cules forman entre s un enlace covalente?
c) Escribe la frmula de los posibles compuestos formados entre ellos.
d) Indica las propiedades generales de este tipo de compuestos.
Realizar representaciones de molculas
covalentes sencillas mediante diagramas
de Lewis.
Conocer los parmetros que determinan
la estructura de las molculas.
Distinguir entre molculas polares y
apolares comprendiendo la diferencia
entre la polaridad de enlace y de
molcula.
Predecir su geometra mediante la
aproximacin del mtodo de repulsin de
pares de electrones de la capa de valencia
(RPECV).
3. Considera las siguientes molculas: tricloruro de boro y tricloruro de
nitrgeno.
a) Escribe sus estructuras de Lewis.
b) Qu geometras tendrn segn la teora de RPECV?
c) Qu ngulos de enlace tendrn?
d) Sern molculas polares?
Interpretar estructuras de molculas
mediante la teora de la hibridacin.
4. Interpreta la geometra de la molcula de dicloruro de berilio (BeCl
2
)
mediante la teora de la hibridacin.
Conocer la distinta naturaleza y fortaleza
de las fuerzas intermoleculares y su
influencia en las propiedades de las
sustancias.
5. Indica qu tipo de enlace o de fuerzas intermoleculares se deben
vencer para realizase los procesos que se indican a continuacin.
a) Fundir cloruro de litio.
b) Tallar un diamante.
c) Fundir hierro.
d) Vaporizar agua.
e) Disolver oxgeno molecular en agua.
f) Disolver cloruro de sodio en agua.
g) Sublimar yodo.
h) Evaporarse acetona.
Identificar las propiedades caractersticas
de los compuestos covalentes reticulares
y moleculares (diferencindolas de las de
los compuestos inicos y metlicos).
6. Ordena de mayor a menor punto de ebullicin las siguientes
sustancias:
NaCl, Fe, cuarzo (SiO
2
), NH3, CCI
4
, CBr
4
, CO
You might also like
- Death Note: L's Theme - PianoDocument4 pagesDeath Note: L's Theme - Pianoorange cake75% (8)
- Death Note: Light Theme - PianoDocument4 pagesDeath Note: Light Theme - Pianoorange cake100% (2)
- La Noche de Los GirasolesDocument12 pagesLa Noche de Los GirasolesRodrigo MendesNo ratings yet
- TX. ROUSSEAU, Edit. AlmadrabaDocument5 pagesTX. ROUSSEAU, Edit. AlmadrabaMonconeNo ratings yet
- IMSLP282256-Suamox Marimba - Jos G. Mart Nez R.Document12 pagesIMSLP282256-Suamox Marimba - Jos G. Mart Nez R.MonconeNo ratings yet
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- IMSLP282256-Suamox Marimba - Jos G. Mart Nez R.Document12 pagesIMSLP282256-Suamox Marimba - Jos G. Mart Nez R.MonconeNo ratings yet
- Death Note: Alumina - PianoDocument3 pagesDeath Note: Alumina - Pianoorange cake100% (2)
- One MetallicaDocument9 pagesOne MetallicaPavlína HulováNo ratings yet
- IMSLP282255-Suamox Score Jos G. Mart Nez R.Document28 pagesIMSLP282255-Suamox Score Jos G. Mart Nez R.MonconeNo ratings yet
- WITTGENSTEIN, Editorial AlmadrabaDocument0 pagesWITTGENSTEIN, Editorial AlmadrabaMonconeNo ratings yet
- IMSLP185741-PMLP322863-Piezas para Cuatro Marimbas-Gerardo Aponte Cupido-ScoreDocument32 pagesIMSLP185741-PMLP322863-Piezas para Cuatro Marimbas-Gerardo Aponte Cupido-ScoreMonconeNo ratings yet
- TX. DESCARTES, Editorial AlmadrabaDocument10 pagesTX. DESCARTES, Editorial AlmadrabaMonconeNo ratings yet
- Ensayo sobre el entendimiento humano de LockeDocument4 pagesEnsayo sobre el entendimiento humano de LockeClaudia LoredoNo ratings yet
- ORTEGA Y GASSET, Editorial AlmadrabaDocument0 pagesORTEGA Y GASSET, Editorial AlmadrabaMonconeNo ratings yet
- San Agustin Libre AlbedríoDocument6 pagesSan Agustin Libre AlbedríoJoaquín Andrés Síñiga Tomasevic100% (2)
- NIETZSCHE, Editorial AlmadrabaDocument0 pagesNIETZSCHE, Editorial AlmadrabaMonconeNo ratings yet
- Tomás de Aquino - Suma Teológica - Comentario de Tezto PAUDocument7 pagesTomás de Aquino - Suma Teológica - Comentario de Tezto PAUJosu EscaladaNo ratings yet
- MARX, Editorial AlmadrabaDocument0 pagesMARX, Editorial AlmadrabaMoncone100% (1)
- Album Musica para Estudiantes Basica MediaDocument241 pagesAlbum Musica para Estudiantes Basica MediaGaston Guillermo Bustos Quintana88% (8)
- Qu Mica - Tema 4 - Termoqu MicaDocument2 pagesQu Mica - Tema 4 - Termoqu MicaMonconeNo ratings yet
- TermoquimicaDocument13 pagesTermoquimicaMonconeNo ratings yet
- Dudas LorenaDocument1 pageDudas LorenaMonconeNo ratings yet
- Quimica 2Document70 pagesQuimica 2Moncone100% (1)
- Programacion 2 Bach. QuimicaDocument3 pagesProgramacion 2 Bach. QuimicaMonconeNo ratings yet
- A1326 1 Problemas Modelo Tema 10Document0 pagesA1326 1 Problemas Modelo Tema 10MonconeNo ratings yet
- Qu Mica - Tema 4 - Termoqu Mica (Gu A)Document9 pagesQu Mica - Tema 4 - Termoqu Mica (Gu A)MonconeNo ratings yet
- Ejerc Pilas y ReaccDocument5 pagesEjerc Pilas y ReaccMonconeNo ratings yet
- A1342 1 Problemas Modelo Tema 12Document0 pagesA1342 1 Problemas Modelo Tema 12MonconeNo ratings yet
- A1341 1 Problemas Modelo Tema 11Document0 pagesA1341 1 Problemas Modelo Tema 11MonconeNo ratings yet
- Diseño A Cortante de Vigas de Concreto ArmadoDocument20 pagesDiseño A Cortante de Vigas de Concreto Armadoscribenauta100% (6)
- Informe Maquinas 12Document7 pagesInforme Maquinas 12jose ibañezNo ratings yet
- Teoría de Las ManiobrasDocument11 pagesTeoría de Las ManiobrasDanielI.GuerraLynchNo ratings yet
- Engranajes FairesDocument65 pagesEngranajes Fairesmario salazarNo ratings yet
- ACTIVIDADES COMPLEMENTARIAS Unidad 3. Normatividad e Instalaciones ResidencialesDocument4 pagesACTIVIDADES COMPLEMENTARIAS Unidad 3. Normatividad e Instalaciones Residencialesdavid zarate40% (5)
- Transformador - Wikipedia, La Enciclopedia Libre PDFDocument12 pagesTransformador - Wikipedia, La Enciclopedia Libre PDFOscar FloresNo ratings yet
- Primera SemanaDocument17 pagesPrimera SemanaJheleyny ZSNo ratings yet
- Ejemplo Calculo Paso A Paso de IluminacionDocument3 pagesEjemplo Calculo Paso A Paso de IluminacionNestor Daniel Puyen MateoNo ratings yet
- Memoria MetalicasDocument57 pagesMemoria MetalicasMauri PorcelliNo ratings yet
- Definición de Las VibracionesDocument13 pagesDefinición de Las VibracionesCarlos Alberto Cermola Izarra60% (5)
- Curso básico de mud loggingDocument171 pagesCurso básico de mud loggingFreddy ASNo ratings yet
- Operaciones Sencillas de LaboratorioDocument8 pagesOperaciones Sencillas de LaboratorioStephanie DubonNo ratings yet
- Valvulas 10Document12 pagesValvulas 10Juan Carlos Bermudez CardenasNo ratings yet
- Clases Series GradientesDocument3 pagesClases Series GradientesEdgar Gil RodriguezNo ratings yet
- Leyes de Newton y movimiento de objetosDocument3 pagesLeyes de Newton y movimiento de objetosKaren PérezNo ratings yet
- MateDocument93 pagesMatejuan pabloNo ratings yet
- Notación científica y cifras significativasDocument23 pagesNotación científica y cifras significativasantonioNo ratings yet
- Optimización Multivariable Irrestricta11Document43 pagesOptimización Multivariable Irrestricta11Angelica Alayo100% (1)
- Ejercicio CementoDocument2 pagesEjercicio CementoHaroldUreñaNo ratings yet
- Polimeros en CarreterasDocument2 pagesPolimeros en CarreterasHugoOliveraNo ratings yet
- Solución Ecuaciones Diferenciales Con Transformada de LaplaceDocument2 pagesSolución Ecuaciones Diferenciales Con Transformada de LaplaceconniemzfNo ratings yet
- Solucion Taller 8Document21 pagesSolucion Taller 8BebeCastroNo ratings yet
- Informe Final Laboratorio de AsfaltosDocument25 pagesInforme Final Laboratorio de Asfaltoselias8260508100% (2)
- Guía N4 Caja Power Shif Colineal MEDocument16 pagesGuía N4 Caja Power Shif Colineal MELuis Enrique CruzNo ratings yet
- Presentación Sellos Mecánicos-RuhrpumpenDocument37 pagesPresentación Sellos Mecánicos-RuhrpumpenAllan SeminarioNo ratings yet
- 25-26 Enrique Escobedo Hernandez - Luis Alberto Zamora CamposDocument191 pages25-26 Enrique Escobedo Hernandez - Luis Alberto Zamora CamposFidel RamonNo ratings yet
- Clase 3 TavDocument5 pagesClase 3 TavMaríaFernanda Zelada ToroNo ratings yet
- Curvas Características TransistorDocument4 pagesCurvas Características TransistorPedro BonillaNo ratings yet
- Trabajo de Mecánica de Fluidos. 2017-I PDFDocument7 pagesTrabajo de Mecánica de Fluidos. 2017-I PDFJoseNo ratings yet
- Calibración termómetros guíaDocument41 pagesCalibración termómetros guíaKarem LastarriaNo ratings yet