Professional Documents
Culture Documents
Actchim2 Reperage Equiv Acidobasique
Uploaded by
Youssef HalloumiCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Actchim2 Reperage Equiv Acidobasique
Uploaded by
Youssef HalloumiCopyright:
Available Formats
ACTIVITE CHIMIE
N2
TS
1/3
REPERAGE DE LEQUIVALENCE DUN TITRAGE ACIDO-BASIQUE
Activit de chimie N2
Reprage de lquivalence dun titrage acido-basique par suivi pH-mtrique
Objectifs de l'activit
� � Savoir comment reprer lquivalence dun titrage acido-basique par suivi pH-mtrique. Savoir choisir un indicateur color acido-basique en vue dun titrage colorimtrique.
1. Raction de titrage acido-basique
Afin de dterminer la concentration apporte CA dacide propanoque C2H5COOH dans une solution, on ralise un titrage en prsence dun indicateur color adapt de fin de titrage. Pour cela : � � on place dans un erlenmeyer un volume VA = 20,0 mL de la solution dacide propanoque ; on verse progressivement une solution dhydroxyde de sodium, Na+(aq) + HO-(aq), de concentration apporte CB = 1,0.10-2 mol.L-1, contenue dans une burette gradue. Rappeler ce quest un titrage.
1.
2. 3. 4. 5.
Lgender le dispositif exprimental utilis ( cf figure ci-contre ). Ecrire lquation de la raction de titrage. Pourquoi ce titrage est-il considr comme acidobasique ? Donner trois conditions pour que la raction dont vous avez crit lquation, convienne pour un titrage. Dfinir lquivalence du titrage dcrit prcdemment. Que se passe-t-il la traverse de ltat dquivalence ?
2. Comment reprer par suivi pH-mtrique, lquivalence dun titrage acidobasique ?
Dans un volume VA = 20,0 mL de solution dacide propanoque concentration apporte CA = 7,0.10-3 mol.L-1, plac dans un bcher additionn de 20,0 mL deau distille, on ajoute progressivement volume VB dune solution dhydroxyde de sodium de concentration solut apporte CB = 1,0.10-2 mol.L-1. de et un en
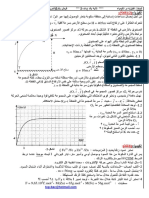
A laide dun pH-mtre, on mesure le pH de la solution contenue dans le bcher aprs chaque ajout ( cf ci-contre le schma du dispositif exprimental de titrage acido-basique). Un logiciel informatique a permis de tracer sur le mme graphique les courbes ( cf page 2) : pH = f(VB) (courbe 1) et
d pH dVB
solution dhydroxyde de sodium 1,0.10-2 mol.L-1
20,0 mL de solution dacide propanoque 7,0.10-3 mol.L-1 + 20,0 mL deau
= g(VB) ( courbe 2 )
ACTIVITE CHIMIE
N2
TS
2/3
REPERAGE DE LEQUIVALENCE DUN TITRAGE ACIDO-BASIQUE
courbe 1
courbe 2
1.
Dcrirer les variations du pH en fonction de VB.
2.
Expliquer lallure de la courbe
d pH dVB
= g(VB).
3. 4.
Dterminer graphiquement labscisse VE du maximum de la drive de pH par rapport VB. Placer sur le graphique le point E de la courbe pH = f ( VB ) dabscisse VB = VE.
5. Que pensez-vous du coefficient directeur de la tangente la courbe pH = f(VB) au point E ? E est un point singulier est appel point dinflexion. 6. Dtermination du volume quivalent VBE
6.1. Complter le tableau davancement de la raction de titrage, en utilisant les grandeurs CA, CB, VA et VBE, volume de solution dhydroxyde de sodium verse lquivalence ( ou volume quivalent ). Avancement Etat initial Equivalence x=0 xquiv + = +
6.2. En supposant que la raction de titrage est totale, tablir la relation entre CA, CB, VA et VBE.
6.3. Calculer la valeur de VBE et la comparer VE. 6.4. Dterminer graphiquement la valeur pHquiv du pH lquivalence. De quel point appel point dquivalence, est-il lordonne ?
ACTIVITE CHIMIE
N2
TS
3/3
REPERAGE DE LEQUIVALENCE DUN TITRAGE ACIDO-BASIQUE
7.
Deux mthodes graphiques de dtermination du volume quivalent.
7.1. Donner partir de ce qui prcde une mthode graphique de dtermination du volume quivalent de base verse. 7.2. Mthode des tangentes parallles On a trac sur le graphique ci-contre deux tangentes parallles la courbe pH = f ( VB ) en deux points situs de part et dautre du point E prcdemment plac sur la courbe. On a trac une perpendiculaire commune (PQ) aux deux tangentes. Replacer le point E sur la courbe. Tracer la mdiatrice du segment PQ. En quel point coupe-t-elle la courbe pH = f(VB) ? Dcrire alors la deuxime mthode ( mthode tangentes ) pour dterminer le volume quivalent. des Q P
3. Titrage colorimtrique : choix dun indicateur color adapt un acido-basique
On dispose de trois indicateurs colors pour Indicateur color titrer lacide propanoque, sans utiliser la vert de bromocrsol mthode pH-mtrique. Les noms de ces indicateurs, leurs teintes acide et basique bleu de bromothymol ainsi que leurs zone de virage sont indiqus rouge de crsol ci aprs. teinte acide Jaune Jaune jaune zone de virage 3,8-5,4 6,0-7,6 7,2-8,8
titrage
teinte basique bleu bleu rouge
1. Placer sur le grand graphique du paragraphe 2, les zones de virage des trois indicateurs : on les reprsentera par des bandes parallles laxe des volumes. 2. Parmi les trois indicateurs, quel est celui ou ceux que lon pourrait utiliser pour raliser un titrage colorimtrique cest dire un titrage pour lequel lindicateur subit un virage brutal lors du passage lquivalence ? Justifier en utilisant le graphique.
3. Quelle condition doit remplir la zone de virage dun indicateur color acido-basique pour quil permette de dterminer avec prcision lquivalence dun titrage acido-basique ?
4. Allure dune courbe de titrage pH-mtrique dans le cas o la base est titrer et se trouve dans le bcher de titrage
Le graphe ci-contre reprsente lallure de la courbe de titrage pH-mtrique, de la base hydrognocarbonate HCO3-(aq) en solution aqueuse, situe dans le bcher, par une solution aqueuse titrante dacide chlorhydrique (situe dans la burette gradue). Sur le graphique, figure galement la courbe dpH/dVA = g ( VA). 1. En appliquant la mthode dgage aux paragraphes prcdents, dterminer le volume quivalent, placer le point dquivalence E et dterminer le pH lquivalence. 2. Que pensez-vous du coefficient directeur de la tangente au point dquivalence la courbe pH = f(VA) ?
VA ( mL )
You might also like
- Chimie B Chap8 Titrage AcidobasiqueDocument6 pagesChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- Série D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Document8 pagesSérie D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Tawfiq Weld EL Arbi75% (4)
- TPC4Document2 pagesTPC4hhedfiNo ratings yet
- TP2 PDFDocument3 pagesTP2 PDFAz-eddine KaibaNo ratings yet
- Cours N 6 (CH) Dosage Acido. (Élév) DocxDocument2 pagesCours N 6 (CH) Dosage Acido. (Élév) Docxcopie masterNo ratings yet
- Analyse de Courbes de Titrage PH MetriquesDocument3 pagesAnalyse de Courbes de Titrage PH MetriquesDaniela DinicaNo ratings yet
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaNo ratings yet
- 53 Bba 01 Ceda 68Document4 pages53 Bba 01 Ceda 68Bøũdįāf KhäwlåNo ratings yet
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution, 2BAC BIOF, SM, PC Et SVT, Prof JENKAL RACHID Exercice 5Document3 pagesSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution, 2BAC BIOF, SM, PC Et SVT, Prof JENKAL RACHID Exercice 5Hiba MellatiNo ratings yet
- tp8 Dosage Phmetrique PDFDocument2 pagestp8 Dosage Phmetrique PDFMokhtarBensaidNo ratings yet
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueBoussetta ZouhaierNo ratings yet
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 pagesSeÌ Rie 1 - Dosage Acido-Basiqueb01554837No ratings yet
- DosageDocument2 pagesDosagePhysique ChimieNo ratings yet
- C8-Sol Tampon PDFDocument7 pagesC8-Sol Tampon PDFsKiroxNo ratings yet
- Dosage DDocument3 pagesDosage DAzzouze HalaouetNo ratings yet
- Transformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Document21 pagesTransformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Abderrazzak ElhaimerNo ratings yet
- 26 Dosage 3Document3 pages26 Dosage 3Ilyes Ben JemaaNo ratings yet
- Https0781948u.index Education - netpronoteFichiersExternes8fDocument5 pagesHttps0781948u.index Education - netpronoteFichiersExternes8fmka araNo ratings yet
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Dosage Acido-Basique FRDocument3 pagesDosage Acido-Basique FRAicha DaouNo ratings yet
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Acides Et Bases PcDocument15 pagesAcides Et Bases Pcrkibi.khadija2006No ratings yet
- AE04-Titrage Destop-REGRESSI-2022-eleves - 2Document4 pagesAE04-Titrage Destop-REGRESSI-2022-eleves - 2Yazine ZeidNo ratings yet
- Analyse Courbe Ph-Métrie 2004-2005Document2 pagesAnalyse Courbe Ph-Métrie 2004-2005Daniela DinicaNo ratings yet
- Titrages Acido-Basiques PDFDocument4 pagesTitrages Acido-Basiques PDFtarikNo ratings yet
- Réactions Acido-Basiques PDFDocument9 pagesRéactions Acido-Basiques PDFAzizElheniNo ratings yet
- Chap 5 ChiDocument7 pagesChap 5 ChiMahmoud FerhatNo ratings yet
- 2008 Pondichery Exo1 Sujet Ammoniac 7ptsDocument3 pages2008 Pondichery Exo1 Sujet Ammoniac 7ptsla physique selon le programme Français100% (1)
- DOSAGE COLORIMETRIQUE Et Phmétrique Aspirine CorrigéDocument3 pagesDOSAGE COLORIMETRIQUE Et Phmétrique Aspirine Corrigétdi44617No ratings yet
- Exbl1 Ts 16-17Document4 pagesExbl1 Ts 16-17Najimou Alade TidjaniNo ratings yet
- dc3 4eme Sadiki 12 MathsDocument5 pagesdc3 4eme Sadiki 12 MathsLotfi BoucharebNo ratings yet
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- Dosage-2Document4 pagesDosage-2hammadi hassineNo ratings yet
- 5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFDocument5 pages5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFkimmikNo ratings yet
- Serie de Révision8 2015 PDFDocument1 pageSerie de Révision8 2015 PDFAzizElheniNo ratings yet
- Bac CD Blanc Regional Ce 2023 Chimie PratiqueDocument2 pagesBac CD Blanc Regional Ce 2023 Chimie PratiqueAnge DavidaNo ratings yet
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiNo ratings yet
- Gsa 2bac 1819 Eb1 PPC FRDocument5 pagesGsa 2bac 1819 Eb1 PPC FRIssam ElNo ratings yet
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadNo ratings yet
- Le PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014Document15 pagesLe PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014RachidaNo ratings yet
- Titrage VinaigreDocument2 pagesTitrage VinaigreDjahid Jo100% (2)
- TS - Chim 8 - TP Ch6Document2 pagesTS - Chim 8 - TP Ch6Omar KhalfiNo ratings yet
- TP Chimie AnalytiqueDocument13 pagesTP Chimie AnalytiqueFedoua Benamer100% (1)
- Dosage PHDocument2 pagesDosage PHOumar TraoréNo ratings yet
- TP N2 PH MetrieDocument15 pagesTP N2 PH MetrieSellam Anis100% (2)
- Série DosageDocument8 pagesSérie DosageAicha Daou100% (1)
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitNo ratings yet
- TP Titrage PhmetriqueDocument8 pagesTP Titrage PhmetriqueSoundous TayssirNo ratings yet
- UntitledDocument3 pagesUntitledLéo DemonNo ratings yet
- Serie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020Document4 pagesSerie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020kathyNo ratings yet
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArNo ratings yet
- Sujetbb 12 Spe 29 JanvDocument6 pagesSujetbb 12 Spe 29 JanvAmza FarelNo ratings yet
- TD-Acide Base - PH - WahabdiopDocument3 pagesTD-Acide Base - PH - WahabdiopNDEYE FATOU CISSE NIASSENo ratings yet
- Solutions Aqueuses IpDocument13 pagesSolutions Aqueuses IpEmmanuel PolvenskyNo ratings yet
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloNo ratings yet
- TP1 PapierDocument5 pagesTP1 Papierismahene KafiNo ratings yet
- 3 Serie 3 2AC Les Droites Remarquables Mohammed Benabdallah S1 2016 2017Document1 page3 Serie 3 2AC Les Droites Remarquables Mohammed Benabdallah S1 2016 2017Youssef HalloumiNo ratings yet
- 3 - serie-3-2AC-Les Droites Remarquables - Mohammed Benabdallah-S1-2016-2017 PDFDocument2 pages3 - serie-3-2AC-Les Droites Remarquables - Mohammed Benabdallah-S1-2016-2017 PDFYoussef HalloumiNo ratings yet
- Devoir 2 - Avril 2012 - PCDocument1 pageDevoir 2 - Avril 2012 - PCYoussef HalloumiNo ratings yet
- 2 - Introduction Aux Bases de La Communication PDFDocument7 pages2 - Introduction Aux Bases de La Communication PDFToutthounNo ratings yet
- MagnetostatiqueDocument17 pagesMagnetostatiquenorddine imad75% (8)
- ds2 - 1er Bac - 07 - 08Document1 pageds2 - 1er Bac - 07 - 08فيزياء السنة الأولىNo ratings yet
- BibliopDocument153 pagesBibliopYoussef HalloumiNo ratings yet
- Méthodologie - La Note de Synthèse - Le RésuméDocument5 pagesMéthodologie - La Note de Synthèse - Le RésuméYoussef HalloumiNo ratings yet
- BibliopDocument153 pagesBibliopYoussef HalloumiNo ratings yet
- 2 - Introduction Aux Bases de La Communication PDFDocument7 pages2 - Introduction Aux Bases de La Communication PDFToutthounNo ratings yet
- MagnetostatiqueDocument17 pagesMagnetostatiquenorddine imad75% (8)
- Exercices Chapitre 4Document7 pagesExercices Chapitre 4Youssef Halloumi100% (2)
- Exercices Et Problemes Corriges de Thermodynamique ChimiqueDocument88 pagesExercices Et Problemes Corriges de Thermodynamique Chimiquehamidoun1285% (110)
- Thermodynamique enDocument61 pagesThermodynamique enYoussef Halloumi0% (1)
- Méthodologie - La Note de Synthèse - Le RésuméDocument5 pagesMéthodologie - La Note de Synthèse - Le RésuméYoussef HalloumiNo ratings yet
- ds2 - 1er Bac - 07 - 08Document1 pageds2 - 1er Bac - 07 - 08فيزياء السنة الأولىNo ratings yet
- M21dbratt PDFDocument1 pageM21dbratt PDFYoussef HalloumiNo ratings yet
- Exercices Chapitre 4Document7 pagesExercices Chapitre 4Youssef Halloumi100% (2)
- logique-3-exercice مبادئ في المنطقDocument3 pageslogique-3-exercice مبادئ في المنطقchahd-05100% (1)
- 1SM FCT Belkha3Document3 pages1SM FCT Belkha3فيزياء السنة الأولىNo ratings yet
- 109135-Nokia 200 Ug FRDocument43 pages109135-Nokia 200 Ug FRYoussef HalloumiNo ratings yet
- Electrostatique Et MagnétostatiqueDocument272 pagesElectrostatique Et MagnétostatiqueLbatal Lmighwar67% (3)
- Methode Resume Synthese Dossier PDFDocument10 pagesMethode Resume Synthese Dossier PDFYoussef HalloumiNo ratings yet
- Cours MecaniqueDocument43 pagesCours Mecaniqueerrairachid100% (2)
- Genera Fonct Exe PDFDocument1 pageGenera Fonct Exe PDFYoussef HalloumiNo ratings yet
- 2 - Introduction Aux Bases de La Communication PDFDocument7 pages2 - Introduction Aux Bases de La Communication PDFToutthounNo ratings yet
- 2009 L1 Feuille 2 BisDocument10 pages2009 L1 Feuille 2 BisYoussef HalloumiNo ratings yet
- ChimieGener 4Document52 pagesChimieGener 4Youssef HalloumiNo ratings yet
- 2 - Introduction Aux Bases de La Communication PDFDocument7 pages2 - Introduction Aux Bases de La Communication PDFToutthounNo ratings yet
- Exercice Verbe Etre Et Avoir - Google SearchDocument1 pageExercice Verbe Etre Et Avoir - Google SearchWafa DridiNo ratings yet
- RecueilExamSMA5 M28Document14 pagesRecueilExamSMA5 M28Gustave KerryNo ratings yet
- TDR Certificat Coach Professionnel - Level 1Document3 pagesTDR Certificat Coach Professionnel - Level 1nicaise djueNo ratings yet
- Les Entraves A La Professionnalisation DDocument13 pagesLes Entraves A La Professionnalisation DFatoumata MaigaNo ratings yet
- 78842-Art3 Brienn N N Robidoux Et Al. 39192-V3N1 201705Document11 pages78842-Art3 Brienn N N Robidoux Et Al. 39192-V3N1 201705Rachid BenhmidouNo ratings yet
- Champ Lexical Du ThéâtreDocument1 pageChamp Lexical Du ThéâtreBurt Son100% (1)
- 3-Effort IntérieurDocument8 pages3-Effort IntérieurGOUAL SaraNo ratings yet
- Dokumen - Tips Cours Mthodes 1 Variable Alatoire Et Loi de ProbabilitDocument10 pagesDokumen - Tips Cours Mthodes 1 Variable Alatoire Et Loi de Probabilitmayar mimiNo ratings yet
- Ecritures Du Moi Lignes de Vie t1Document544 pagesEcritures Du Moi Lignes de Vie t1david balibalNo ratings yet
- Sourah WaqiahDocument106 pagesSourah WaqiahFleur De Lune100% (4)
- Comment Poser Des Questions FerméesDocument2 pagesComment Poser Des Questions FerméesDalila RgNo ratings yet
- Mohamed Sifaoui - Où Va L'algérie... Et Les Conséquences Pour La France PDFDocument248 pagesMohamed Sifaoui - Où Va L'algérie... Et Les Conséquences Pour La France PDFikonten4267% (3)
- 874-Article Text-3260-1-10-20230113Document17 pages874-Article Text-3260-1-10-20230113khadija rabibNo ratings yet
- FR NeurologieDocument17 pagesFR Neurologiemaroxibo100% (1)
- 2.2.4.11 Lab - Configuring Switch Security FeaturesDocument10 pages2.2.4.11 Lab - Configuring Switch Security FeaturesOumou DialloNo ratings yet
- 10 ALADIAHDocument2 pages10 ALADIAHNicolasNo ratings yet
- ConjugaisonDocument3 pagesConjugaisonromeroniNo ratings yet
- Examen2 Structure Machine 2Document1 pageExamen2 Structure Machine 2benhadjeba boumedyenNo ratings yet
- 7 Geometrie de L'espaceDocument16 pages7 Geometrie de L'espaceKakou Light MalanNo ratings yet
- 1.3.1. La SubordinationDocument6 pages1.3.1. La SubordinationFrédéric LetellierNo ratings yet
- ISO9001Document66 pagesISO9001Mostafa BelaaroussiNo ratings yet
- Neuro PsychoDocument352 pagesNeuro PsychoNounou NouhadeNo ratings yet
- Organisation D'un Service D'audit InterneDocument49 pagesOrganisation D'un Service D'audit InterneSouha Layane100% (46)
- Appel Fouad LarouiDocument4 pagesAppel Fouad LarouihattabsatNo ratings yet
- Sturdza - Europe Orientale Et Le Role Historique Des MaurocordatoDocument519 pagesSturdza - Europe Orientale Et Le Role Historique Des Maurocordatobogdancretu21011978No ratings yet
- TURCS Et MONTENEGRiNS: F.LENORMANT, 1866 PARiSDocument524 pagesTURCS Et MONTENEGRiNS: F.LENORMANT, 1866 PARiSYasef BayNo ratings yet
- Traitement de l'HTADocument15 pagesTraitement de l'HTABMA-medecineNo ratings yet
- Cours IE - Fahd ASSILADocument45 pagesCours IE - Fahd ASSILAadnane.iherkachen100% (1)
- استشهادات تطبيق الكفاياتDocument80 pagesاستشهادات تطبيق الكفاياتselotmani100% (1)
- Fonctions Executives CB - 3 DiapoDocument19 pagesFonctions Executives CB - 3 DiapoFARHAT HAJERNo ratings yet