Professional Documents
Culture Documents
A0409 Quimica General Actividades
Uploaded by
Luis E. RocaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
A0409 Quimica General Actividades
Uploaded by
Luis E. RocaCopyright:
Available Formats
ACTIVIDAD
Desarrollo
de contenidos
Diagrama
Diagrama
Desarrollo
de contenidos
Desarrollo
Objetivos
de contenidos
Actividades
Lecturas
seleccionadas
Objetivos
Inicio
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
UNIDAD I: MATERIA Y ENERGA
Actividades
Inicio
Autoevaluacin
ACTIVIDAD N 1:
Autoevaluacin
Glosario
Bibliografa
PRCTICA DE LABORATORIO No 1: RECONOCIMIENTO DE MATERIALES DE LABORATORIO
Lecturas
seleccionadas
Recordatorio
Glosario
Bibliografa
I.
OBJETIVOS:
Recordatorio
Anotaciones
1. Reconocer las normas de seguridad en el laboratorio.
2. Identificar, describir y sealar los usos y funciones de cada uno de los materiales
de laboratorio.
Anotaciones
3. Reconocer, describir, comprender la estructura y materiales empleados en la
fabricacin de los materiales, instrumentos y equipos de ms uso en los trabajos
de laboratorio.
4. Conocer la manipulacin de reactivos; lquidos y slidos, diferenciando el reactivo comercial de un reactivo qumicamente puro.
5. Familiarizarse con los materiales de vidrio y otros.
II. MATERIALES, EQUIPOS E INSTRUMENTOS
Se pueden clasificar de acuerdo:
1. MATERIALES DE MEDICIN
Probetas graduadas
Buretas
Pipetas
Picnmetro
Frasco cuenta gotas
Vasos de precipitado
Fiola
Papeles indicadores
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
2. INSTRUMENTOS PARA MEDICIN
a. Balanzas: de triple brazo, elctrica, digital y analtica
b. Densmetros o aermetros
c. Manmetros
d. Voltmetro
e. Ampermetro
f. Potencimetro
g. Cronmetro y reloj
h. Termmetros
3. MATERIALES PARA SEPARACIN
a. Embudos: de vstago corto y largo
b. Embudos Buchner
c. Peras de separacin o decantacin
d. Papel de filtro
e. Tamices metlicos
4. EQUIPOS DE SEPARACIN
a. De secado
b. Centrfugas
c. Decantadores
d. De extraccin
e. De destilacin, refrigerantes
Bibliografa
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
5. MATERIALES VARIADOS (sirven para combinacin, reaccin y mezclas)
Anotaciones
a. Tubos de prueba
b. Vasos de precipitado
c. Balones de fondo plano o esfrico
d. Crisoles
e. Cpsulas
f. Erlenmeyer
g. Lunas de reloj
6. MATERIALES DE CALENTAMIENTO
a. Mecheros de bunsen y alcohol
b. Estufas
c. Mufla elctrica
d. Planchas elctricas
7. MATERIALES DE SOSTN O SOPORTE
a. Soporte universal
b. Rejillas
c. Pinzas
d. Trpodes
e. Nueces
f. Gradilla
g. Anillo de extensin
8. MATERIALES PARA CONSERVACIN
a. Frascos para reactivos (polietileno y vidrios transparentes y oscuros)
b. Desecadores
c. Goteros
9. MATERIALES PARA USOS DIVERSOS
a. Varillas de vidrio
b. Mangueras de goma
c. Esptulas
d. Escobillas
e. Tubo de desprendimiento
f. Tapones de goma o corcho
g. Morteros de vidrio y porcelana
10. POR LA CLASE DE MATERIAL EMPLEADO EN SU FABRICACIN
a. MADERA: Gradillas para tubos, soportes para embudos.
b. VIDRIO: Vasos de precipitacin, tubos de ensayo, etc.
c. NO METLICO: Crisoles, cpsulas, etc.
d. ACERO: Material de alta resistencia fsica, es una mezcla de hierro, cromo,
nquel, bronce, latn, carbn (soporte universal, pinzas, etc.)
e. PLSTICO: Picetas, probetas, etc.
REPORTE N 1: RECONOCIMENTO DE MATERIALES E INSTRUMENTOS DE LABORATORIO
INSTRUCCIONES:
Completa la informacin requerida y responde de manera clara y concreta las siguientes
preguntas relacionadas con la prctica. Esta actividad se presentara a travs del aula virtual.
-------------------------------------------------------------------------------------------------------------------------------------------------------------
ACTIVIDAD
Desarrollo
de contenidos
1. Reporte de resultados: (6p)
MATERIAL
PROBETA
GRADUADA
TUBO DE
ENSAYO
VASO DE
PRECIPITADOS
MATRAZ
ERLENMEYER
EMBUDO
PERA DE
DECANTACIN
CAPSULA
BAGUETA
SOPORTE
UNIVERSAL
PIPETA
CRISOL
CENTRFUGA
NUEZ
PINZA PARA
TUBOS
GRAFICO
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
FUNCIN
Bibliografa
CAPSULA
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
BAGUETA
SOPORTE
UNIVERSAL
Anotaciones
PIPETA
CRISOL
2.CENTRFUGA
Investiga, para qu se emplea la destilacin, y qu materiales se usan para efectuarla? (6p)
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------NUEZ
-----------------------------------------------------------------------------------------------------------------------------------------------------
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------PINZA PARA
TUBOS
------------------------------------------------------------------------------------------------------------------------------------------------------
3. Conclusiones: (8p)
a. Los materiales
BURETA
de laboratorio se utilizan para:
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
PINZA PARA
CRISOL
----------------------------------------------------------------------------------------------------------------------------------------------
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
b. Existen materiales de vidrio que se pueden calentar, tales como:
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
c. De acuerdo a su tipo de material de fabricacin, los instrumentos de laboratorio se clasifican en:
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
ACTIVIDAD
Desarrollo
de contenidos
Lecturas
seleccionadas
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------Objetivos
Desarrollo
de contenidos
Actividades
Inicio
ACTIVIDAD N 2:
Autoevaluacin
PRCTICA DE LABORATORIO N 2: MEZCLAS Y COMBINACIONES
Lecturas
seleccionadas
Glosario
Bibliografa
I. OBJETIVOS:
1. Aplicar diferentes procedimientos para separar mezclas.
2. identificar en el ambiente, la presencia de mezclas, elementos y compuestos.
Recordatorio
Glosario
d. Los instrumentos que miden con mayor exactitud los volmenes de lquidos
son: (ordnelos de mayor a menor exactitud).
Recordatorio
----------------------------------------------------------------------------------------------------------------------------------------------
Diagrama
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
3. Diferenciar una mezcla homognea de una heterognea
Anotaciones
4. Diferenciar una mezcla de una combinacin
II. FUNDAMENTO TERICO:
A. MEZCLA
Es la reunin de dos o ms sustancias qumicas en cualquier proporcin, donde las propiedades de los componentes se conservan, o sea no hay combinacin
qumica; por lo tanto, son susceptibles a la separacin por medios mecnicos o
fsicos.
B. MEZCLA HOMOGNEA O SOLUCIN
Es aquella que, a simple vista o con ayuda de instrumentos como el microscopio, no se puede diferenciar la separacin de sus componentes; por lo tanto,
constituye una masa homognea, pues cualquier porcin que se tome tendr la
misma composicin y propiedades.
C. MEZCLA HETEROGNEA
Es aquella que a simple vista o con ayuda de instrumentos, se diferencia la separacin de sus componentes, y cualquier porcin que se tome tendr composicin y propiedades diferentes.
D. COMBINACIN
Es la reunin de dos o ms sustancias qumicas en proporciones definidas, donde las propiedades de los componentes iniciales no se conservan, dando lugar a
otras sustancias con propiedades diferentes.
III. MATERIALES Y REACTIVOS
MATERIALES
1 cocina domstica
1 tubo de ensayo 13100
2 frascos de vidrio con tapa
2 frascos de vidrio pequeo
2 papel filtro cualitativo
1 pinza depiladora
1 vaso mediano
1 cuchara pequea
1 imn
Anotaciones
Bibliografa
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
REACTIVOS
Agua de cao
Alcohol medicinal
Anotaciones
Arena
Clavo de hierro
Cloruro de sodio (NaCl),sal de cocina
Gasolina o aceite 25 ml
Limaduras de hierro (Fe)
Papel filtro (farmacia)
Talco de tocador
IV. PROCEDIMIENTO EXPERIMENTAL
Esta prctica ser realizada por el estudiante. El reporte se presentar a travs del aula
virtual.
EXPERIMENTOS
1. En un vaso de pp. prepare una mezcla de arena (seca) y limaduras de hierro y
mover utilizando una cucharita.
Cmo se puede separar los componentes de esta mezcla?
Determina el tipo de mezcla y el mtodo de separacin ms eficiente.
Separa los componentes segn el mtodo que creas conveniente.
2. Disuelve una cucharada de sal de cocina en un vaso con agua
Cmo se puede separar los componentes de esta mezcla?
Determina el tipo de mezcla y el mtodo de separacin ms eficiente.
3. En un frasco pequeo transparente con tapa, vierte un poco de agua y talco;
agite y deja reposar.
El agua que se mantiene con partculas suspendidas constituye una
SUSPENSIN.
Determina el tipo de mezcla y el mtodo de separacin ms eficiente.
4. En un vaso vierte en igual proporcin agua y gasolina. Agita y deja reposar.
Cmo se llama la mezcla?
Separa los componentes segn el mtodo que creas conveniente.
5. Vierte en un tubo de ensayo igual proporcin de agua y alcohol.
Indica si son lquidos miscibles o inmiscibles.
Cmo se llama la mezcla?
Indica y explica el mtodo de separacin ms eficiente
6. Deja a la intemperie un clavo pequeo y deja pasar una semana. Luego observa
qu cambios sufri el clavo?, se puede obtener de nuevo el clavo en su estado
inicial?, se trata de una mezcla o una combinacin?
7. Con la ayuda de una pinza mltiple, expn a la llama de la cocina un hilo de
cobre reciclado de un cable en desuso.
Identifica si se trata de una mezcla o una combinacin.
Qu cambios sufri el hilo de cobre?
Todas las preguntas que se realizan en los procedimientos deben incluir las respuestas
en el rubro de observaciones del reporte.
REPORTE N 2: MEZCLAS Y COMBINACIONES
INSTRUCCIONES:
Completa la informacin requerida e informa de manera clara y concreta los siguientes aspectos relacionadas con la prctica.
ACTIVIDAD
Desarrollo
de contenidos
1. Reporte de resultados de tipos y mtodos de separacin de mezclas (6p)
N DE
EXPERIENCIA
TIPO DE MEZCLA
METODO DE
SEPARACION
OBSERVACIONES
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
2. Reporte de resultados de mezclas y combinaciones (6p)
3. Indica por lo menos dos conclusiones (referentes a la prctica). Tomar como ejemplo las conclusiones de la prctica 1. (8p)
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Bibliografa
Actividades
Autoevaluacin
Glosario
Bibliografa
Anotaciones
ACTIVIDAD
Diagrama
Diagrama
Desarrollo
Objetivos
de contenidos
Desarrollo
de contenidos
Actividades
Lecturas
seleccionadas
Objetivos
Inicio
UNIDAD II: TEORA ATMICA
Actividades
Inicio
Autoevaluacin
ACTIVIDAD N 1:
Autoevaluacin
Glosario
Bibliografa
PRCTICA DE LABORATORIO N 1: ESPECTROS
Lecturas
seleccionadas
Recordatorio
Glosario
Bibliografa
OBJETIVO
Recordatorio
Anotaciones
Explicar cualitativamente las caractersticas del espectro de emisin que se producen cuando algunas sustancias son expuestas a la llama del mechero de Bunsen o a
una fuente de electricidad de alto voltaje, y el estudio de esta caracterstica relacioAnotaciones
nado con la estructura atmica.
FUNDAMENTO TERICO
A. Estructura atmica.- En la historia del desarrollo de la teora de la estructura atmi
ca, hubo en esencia tres grandes pasos:
El descubrimiento de la naturaleza elctrica de la materia.
El descubrimiento de que el tomo consiste en un ncleo rodeado de electrones
El descubrimiento de las leyes mecnicas que gobiernan la conducta de los electrones
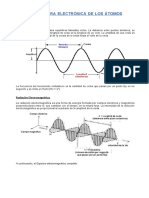
B. Espectros de absorcin y emisin: Son las huellas digitales de los elementos. Cada
elemento posee una serie nica de longitudes de onda de absorcin o emisin.
Un espectro de emisin se obtiene por el anlisis espectroscpico de una fuente
de luz, como puede ser una llama o un arco elctrico. As cuando los gases se calientan, se excitan sus tomos o molculas (por ejemplo: He, Ne, Ar, N, H, etc.)
y emiten luz de una determinada longitud de onda. Este fenmeno es causado
fundamentalmente por la excitacin de tomos por medios trmicos o elctricos.
Cuando se calientan sales de determinados elementos en una llama, son ejemplos
de espectros de emisin, en realidad, todo material slido, cuando se calienta cerca
de 1600C, emite luz visible.
La energa absorbida induce a los electrones que se encuentran en un estado fundamental, a un estado mayor de energa. El tiempo de vida de los electrones en;
esta situacin meta estables es corto y vuelve a un estado de excitacin ms bajo o al
estado fundamental, la energa absorbida se libera bajo la forma de luz. En algunos
casos, los estados excitados, pueden tener un periodo de vida apreciable, como el
caso de la emisin de luz contina, despus que la excitacin ha cesado, este fenmeno se denomina fosforescencia.
PARTE EXPERIMENTAL
A. MATERIALES
Mechero de Bunsen
Tubos de ensayo 13x100
Alambre de Nicrm N 14
Lunas de reloj
B. REACTIVOS
SrCl2 NaCl
CaCl2 KCI
BaCl2 LiCl
CuO HCl(cc)
PROCEDIMIENTO:
Esta prctica ser presentada en un video demostrativo que usted encontrar en el aula
virtual. El reporte se presentar a travs del aula virtual.
ACTIVIDAD
Desarrollo
de contenidos
Encienda el mechero de Bunsen, regule y genere una llama no luminosa.
Lecturas
seleccionadas
Coloque el extremo argollado de uno de los alambres de Nicrn en la parte ms
caliente (zona de mayor temperatura o cono externo) de la llama observe el color
amarillo que se produce, ser necesario eliminar, para lo cual introducir en cido
Recordatorio
clorhdrico concentrado, y llevar a la llama observando la coloracin.
Repetir esta operacin cuantas veces sea necesario hasta no ver el color amarillo de
la llama.
Una vez limpio el alambre, introdzcalo nuevamente en el cido y luego en la sustancia que se le ha entregado.
Coloque la muestra insertada en el alambre en la zona de la llama indicado anteriormente y observe el color que ms predomina y anote lo observado.
Siga el mismo procedimiento con las otras sustancias de ensayo y empleando cada
vez un alambre de nicrm rotulado por cada sustancia, no mezclarlos.
De acuerdo a los resultados obtenidos, identifique a cada uno de las sustancias utilizadas en el experimento.
REPORTE N 1: ESPECTROS
INSTRUCCIONES: Responda de manera clara y concreta las siguientes preguntas relacionadas con la prctica.
1. En base a los colores de los espectros de emisin observadas en el experimento.
Completar el siguiente cuadro.
ELEMENTO
COLOR EMITIDO
PREDOMINATE
DE LA RADIACION
Longitud de onda
(nm).(Ver anexo)
Estroncio
Calcio
Bario
Cobre
Sodio
Potasio
Litio
Frecuencia
(Hertz)
Energa de un
fotn (joule)
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Glosario
Anotaciones
Bibliografa
10
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
2. Calcular la energa en joules de:
a. Un fotn cuya longitud de onda es de 5x104 nm. En qu zona del REM se
encuentra?
Anotaciones
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------b. Un fotn cuya longitud de onda es de 5x10-2 nm. En qu zona del REM se encuentra?
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------3. Indique sus conclusiones
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
ANEXO:
COLOR
LONGITUD DE ONDA (nm)
Ultravioleta
< 380
Violeta
380-455 nm
Azul
455-492 nm
Verde
492-577 nm
Amarillo
577-597 nm
Naranja
597-622 nm
Rojo
622-780 nm
Infrarrojo
>780 nm.
ACTIVIDAD
Desarrollo
de contenidos
Diagrama
Diagrama
Desarrollo
de contenidos
Desarrollo
Objetivos
de contenidos
Actividades
Lecturas
seleccionadas
Objetivos
Inicio
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
UNIDAD III: TABLA PERIODICA Y ENLACE QUMICO
Actividades
Inicio
Autoevaluacin
ACTIVIDAD N 1:
Autoevaluacin
Glosario
Bibliografa
PRCTICA DE LABORATORIO N 1: RECONOCIMIENTO DE LOS ELEMENTOS DE
LA TABLA PERIDICA
Lecturas
seleccionadas
Glosario
Recordatorio
Bibliografa
Anotaciones
I. OBJETIVOS
Observar algunos elementos qumicos representativos de las principales familias
de la tabla peridica.
Recordatorio
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Anotaciones
Determinar las caractersticas fsicas como estado fsico, color y densidad de algunos elementos, con el fin de identificarlos y comprobar la utilidad de la tabla
peridica.
II. FUNDAMENTO TERICO
Con el descubrimiento de los primeros elementos se desarroll la idea de que los
tomos de algunos elementos podran tener ciertas propiedades anlogas a las de
otros; naci con ello la idea de clasificar los elementos conocidos con base en alguna propiedad semejante. Los cientficos a lo largo de la historia trabajaron en esto,
como se describe en este manual. Actualmente la clasificacin de los elementos se
basa en la configuracin electrnica externa y tambin se le ha dado el nombre
de tabla cuntica de los elementos. Los elementos qumicos estn clasificados en
estricto orden creciente de su nmero atmico.
III. PARTE EXPERIMENTAL
A. REACTIVOS:
Aluminio, azufre, bromo, calcio, carbono, cobre, cromo, estao, fierro, fsforo,
litio, magnesio, manganeso, mercurio, molibdeno, nquel, plata, platino, plomo, potasio, silicio, sodio, titanio, yodo, zinc, oro.
B. PROCEDIMIENTO:
El estudiante conseguir en ferreteras u hojalateras elementos puros para su
estudio. Como los elementos del grupo IA y VIIA son difciles de encontrar por
su alta reactividad, deber buscar la informacin en libros o en Internet.
El reporte se entregara mediante el aula virtual.
EXPERIMENTO 1: METALES ALCALINOS
Identifique los elementos que pertenecen a los metales alcalinos
Observe las caractersticas fsicas de dichos elementos
Cmo se conservan dichos elementos?
Cules son las caractersticas principales de los metales alcalinos?
EXPERIMENTO 2: METALES ALCALINOS TRREOS
Identifique los elementos que pertenecen a los metales alcalinos trreos
Observe las caractersticas fsicas de dichos elementos
Cules son las caractersticas principales de los metales alcalinos trreos?
EXPERIMENTO 3: METALES DE TRANSICIN
Identifique los elementos que pertenecen a los metales de transicin
Observe las caractersticas fsicas de dichos elementos
Cules son las caractersticas principales de los metales de transicin?
EXPERIMENTO 4: NO METALES
Bibliografa
11
12
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
Identifique los elementos que pertenecen a los no metales
Observe las caractersticas fsicas de dichos elementos
Cules son las caractersticas principales de los no metales?
Anotaciones
REPORTE N 1: TABLA PERIODICA
INSTRUCCIONES:
Completa de manera clara y concreta los siguientes aspectos relacionados con la
prctica.
1. Tabla de resultados. (4p)
N
ELEMENTO
01
Aluminio
02
Azufre
03
Bromo
04
Calcio
05
Carbono
06
Cobre
07
Cromo
08
Estao
09
Fierro
10
Fsforo
11
Litio
12
Magnesio
13
Manganeso
14
Mercurio
15
Molibdeno
16
Nquel
17
Plata
18
Platino
19
Plomo
20
Potasio
21
Silicio
22
Sodio
23
Titanio
24
Yodo
25
Zinc
26
Oro
SIMBOLO
ESTADO FISICO
COLOR
DENSIDAD
ACTIVIDAD
Desarrollo
de contenidos
Lecturas
seleccionadas
2. Tabla de resultados. (4p)
SIMBOLO
CONFIGURACION
ELECTRONICA
DESARROLLADA
CONFIGURACIN
ELECTRONICA
SIMPLIFICADA
GRUPO Y
PERIODO
Recordatorio
M/NM/METALOIDE
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3. Tabla
18 de resultados. (4p)
19
20
21
FAMILIA
SIMBOLOS
CARACTERISTICAS COMUNES
(FAMILIA)
22
METALES ALCALINOS
23
24
METALES ALCALINOS
25
TERREOS
26
BOROIDES
METALES DE TRANSICIN
CARBONOIDES
ANFIGENOS
HALOGENOS
NITROGENOIDES
4. Averiguar las principales aplicaciones de los siguientes elementos: calcio, cobre, cloro, aluminio, yodo, fsforo, hierro, platino, titanio e iridio. (3p)
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Glosario
Anotaciones
Bibliografa
13
14
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
5. Escriba sus conclusiones sobre la prctica realizada (por lo menos 2 conclusiones (5p)
-------------------------------------------------------------------------------------------------------------------------------------------------------------
Anotaciones
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------Diagrama
Objetivos
Desarrollo
de contenidos
Actividades
Inicio
ACTIVIDAD N 2:
Autoevaluacin
PRCTICA DE LABORATORIO N 2: ENLACES QUMICOS
Lecturas
seleccionadas
Glosario
Bibliografa
I. OBJETIVOS:
1. Aplicar la tcnica para identificar el tipo de enlace qumico en la mayor parte de
los compuestos.
Recordatorio
2. Identificar los compuestos inicos y moleculares.
Anotaciones
3. Encontrar una relacin entre la solubilidad y la polaridad de una sustancia con
respecto a un solvente determinado.
4. Establecer la diferencia entre una solucin inica, parcialmente inica y covalente de acuerdo a su conductividad elctrica.
II. FUNDAMENTO TERICO
El enlace qumico es la unin de tomos, iones y molculas para formar entidades
ms estables con propiedades diferentes a los originales. Su estudio ayuda a entender las fuerzas que participan en los diversos tipos de enlaces a nivel interatmico
o intermolecular.
A. Enlace Inico: Se debe a interacciones electrostticas entre los iones que
pueden formarse por la transferencia de uno o ms electrones de un tomo o
grupo de tomos y en el estado slido se encuentran formando cristales debido
a su energa reticular.
El enlace inico se forma como resultado de la transferencia de electrones del
elemento metlico a un no metlico durante una reaccin qumica; los metales
al perder los electrones se transforman en iones positivos y los no metales al
ganar electrones se hacen iones negativos, originndose as una fuerte atraccin
electrosttica entre ambos.
Los enlaces inicos son muy estables y resisten altas temperaturas sin descomponerse qumicamente (no son combustibles), son solubles en agua, al disolverse
se disocian en iones que conducen la corriente elctrica.
B. Enlace Covalente: Se debe a que se comparten uno o ms pares de electrones
de valencia entre dos tomos generalmente no metlicos, por la formacin de
orbitales moleculares a partir de orbitales atmicos.
Se forma como resultado de la comparticin de electrones entre no metales
durante una reaccin qumica. Este enlace forma molculas con existencia individual. Las sustancias covalentes tienen bajo punto de fusin y ebullicin, se
descomponen por el calor y la mayora de ellos son combustibles.
Las sustancias de origen covalente son solubles en alcohol, bencina y son
poco solubles y en algunos casos insolubles en agua, por lo que no conducen la
corriente elctrica, caracterstico de compuestos orgnicos.
ACTIVIDAD
Desarrollo
de contenidos
Lecturas
seleccionadas
C. Enlace Metlico: Se produce por la unin de los tomos formando una red
cristalina de iones metlicos (+) mientras que los electrones de valencia dbilmente sujetos se desplazan libremente similar a un fluido (flujo de electrones),
lo que se conoce como corriente elctrica, por todo el metal. La mayora Recordatorio
son
slidos, tenaces, dctiles y maleables, presentan puntos de fusin y ebullicin
elevados. Conducen la electricidad en estado slido.
III. MATERIALES Y REACTIVOS
MATERIALES:
01 equipo de conductividad
01 gradilla para tubos
01 pinza para tubos
01 probeta de 10 ml
02 lunas de reloj
05 tubos de prueba
08 vasos de precipitacin de 150 ml
REACTIVOS:
1 barra y virutas de aluminio
1 barra de cobre
1 barra de hierro
1 g de cloruro de sodio
1 g de sulfato de cobre
1 ml de cido clorhdrico
1 ml de bencina
1 ml de tetra cloruro de carbono
1 papa mediana
50 ml de cido clorhdrico al 1 N
50 ml de agua destilada
50 ml de agua potable
50 ml de alcohol
50 ml de bencina
50 ml de cloruro de sodio al 1 N
50 ml de sulfato de cobre al 1 N
50 ml de zumo de limn
IV. PROCEDIMIENTO EXPERIMENTAL
Esta prctica ser presentada en un video demostrativo que usted encontrar en el
aula virtual. El reporte se presentar a travs del aula virtual.
EXPERIMENTO 1: SOLUBILIDAD
1. En un tubo de ensayo verter 3 ml de agua destilada y agregar 1 g de sulfato de
cobre; agitar y anotar sus observaciones.
2. En un tubo de ensayo verter 3 ml de agua destilada y agregar 1 ml de tetracloruro de carbono; agitar y anotar sus observaciones.
3. En un tubo de ensayo verter 3 ml de agua destilada y agregar 1 ml de benceno;
agitar y anotar sus observaciones.
4. En un tubo de ensayo verter 3 ml de agua destilada y agregar 1 g de cloruro de
sodio; agitar y anotar sus observaciones.
5. En un tubo de ensayo verter 3 ml de agua destilada y agregar 1 ml de cido clorhdrico ; agitar y anotar sus observaciones
6. En un tubo de ensayo verter 3 ml de agua destilada y agregar virutas de aluminio, calentar y anotar sus observaciones.
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Glosario
Anotaciones
Bibliografa
15
16
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
EXPERIMENTO 2: CONDUCTIVIDAD ELCTRICA DE ENLACE INICO Y COVALENTE
Anotaciones
1. Se utilizan las barras de metales para cerrar el circuito del dispositivo electrnico, utilizando una pinza aislante. Anote sus observaciones.
2. En un vaso de precipitados de 150 ml verter 50 ml de agua destilada e introducir
los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar
el equipo. Anote sus observaciones.
3. En un vaso de precipitados verter 50 ml de agua potable e introducir los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar el
equipo. Anote sus observaciones.
4. En un vaso de precipitados verter 50 ml de zumo de limn e introducir los
electrodos del equipo de conductividad hasta la mitad del lquido y enchufar el
equipo. Anote sus observaciones.
5. En un vaso de precipitados verter 50 ml de cloruro de sodio al 1 N, e introducir
los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar
el equipo. Anote sus observaciones.
6. En un vaso de precipitados verter 50 ml de cido clorhdrico al 1 N, e introducir
los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar
el equipo. Anote sus observaciones.
7. En un vaso de precipitados verter 50 ml de sulfato de cobre al 1 N, e introducir
los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar
el equipo. Anote sus observaciones.
8. En un vaso de precipitados verter 50 ml de benceno, e introducir los electrodos
del equipo de conductividad hasta la mitad del lquido y enchufar el equipo.
Anote sus observaciones.
9. Coger una papa mediana, introducir los electrodos del equipo de conductividad
hasta la mitad de la papa y enchufar el equipo. Anote sus observaciones.
10 En un vaso de precipitados verter 50 ml de alcohol, e introducir los electrodos
del equipo de conductividad hasta la mitad del lquido y enchufar el equipo.
Anote sus observaciones.
11. En un vaso de precipitados verter 50 ml de tetracloruro de carbono, e introducir
los electrodos del equipo de conductividad hasta la mitad del lquido y enchufar
el equipo. Anote sus observaciones.
REPORTE N 2: ENLACES QUMICOS
INSTRUCCIONES:
Complete de manera clara y concreta los siguientes aspectos relacionados con la prctica.
1. Tabla de resultados (4p)
SUSTANCIA
Sulfato de cobre
Tetracloruro de
carbono
Benceno
Cloruro de sodio
cido clorhdrico
Etanol
Virutas de
aluminio
FORMULA
SOLUBILIDAD EN AL
AGUA (disolvente polar)
TIPO DE ENLACE
ACTIVIDAD
Desarrollo
de contenidos
Lecturas
seleccionadas
2. Reporte de resultados (8p)
Sustancia
Identificar
compuestos
o tipo de
mezclas
Conductividad
(si/no)
Identificar
iones Anion,
cation
Escritura de
Lewis para
los
compuestos
Hallar E para
Recordatorio
los compuestos
y determinar el
tipo de enlace
Aluminio
Cobre
Plomo
Agua
destilada
Agua
potable
Cloruro de
sodio
(slido)
Cloruro de
sodio
(solucin)
cido
clorhdrico
Sulfato de
cobre
(slido)
Sulfato de
cobre.
(solucin)
Benceno
Papa
Etanol
Tetracloruro de
carbono
3. Escriba por lo menos 2 conclusiones sobre a la prctica (8p).
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Glosario
Anotaciones
Bibliografa
17
18
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
Diagrama
Objetivos
Inicio
UNIDAD IV: FUNCIONES INORGNICAS, REACCIONES QUMICAS
Y SOLUCIONES
Anotaciones
Diagrama
Desarrollo
de contenidos
Desarrollo
de contenidos
Actividades
Objetivos
Inicio
Lecturas
seleccionadas
Glosario
Actividades
Autoevaluacin
Bibliografa
ACTIVIDAD N 1:
Autoevaluacin
PRCTICA
DE LABORATORIO N 1: FUNCIONES INORGNICAS
Recordatorio
Anotaciones
Lecturas
seleccionadas
Recordatorio
Glosario
Bibliografa
I OBJETIVOS:
Sintetiza en el laboratorio las principales funciones qumicas
Realiza reacciones qumicas, frmula y nombra utilizando las nomenclaturas
(Tradicional, IUPAC y Stock) de los productos sintetizados.
Anotaciones
Valora el trabajo grupal y realiza su trabajo en forma cientfica respetando las
normas de seguridad e higiene.
II. FUNDAMENTO TERICO:
La qumica est presente en todo lo que nos rodea, las reacciones qumicas se dan en
la naturaleza de manera espontnea o inducida para que la vida sea posible. En el laboratorio la capacidad para crear reacciones qumicas tiles o para entenderlas, viene
dada por el dominio del conocimiento de todos aquellos elementos que intervienen
en una reaccin.
La qumica tiene un lenguaje particular que permite identificar compuestos de
manera universal. La nomenclatura permite el uso de nombres sistemticos tiles
en la identificacin precisa de la composicin qumica, en el trabajo cientfico y en
la industria.
Actualmente existen tres tipos de nomenclatura: la Stock en honor al qumico Alemn Alfred Stock, la nomenclatura tradicional y la establecida por la I.U.P.A.C.
(Unin Internacional de Qumica Pura y Aplicada), llamada tambin funcional
o sistemtica, con el tiempo se espera que esta ltima sustituya el uso de los otros
sistemas de nomenclatura.
III. MATERIALES Y REACTIVOS
A. MATERIALES.
3 lunas reloj
1 pinza de uso mltiple
1 mechero de alcohol
1 tubo de ensayo 13 x 100
1 tubo de ensayo 13 x 100 con tapa
1 gradilla para tubos
1 frasco lavador
1 cucharilla de combustin
1 pinza para tubos
1 matraz de 125 ml con tapn de jebe
1 equipo sulfidricador
1 estufa
1 mechero de alcohol
2 vaso de precipitados de 150 ml
1 rejilla de asbesto
1 varilla de vidrio
1 capsula de evaporacin
ACTIVIDAD
Desarrollo
de contenidos
B. REACTIVOS
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
Azufre en polvo
Cinta de magnesio
Cobre
Fenolftalena
Oxido de magnesio
Papel de tornasol rojo y azul
Sodio
cido clorhdrico
cido sulfrico
Anaranjado de metilo
Azufre en polvo
Hidrxido de magnesio
Hidrxido de sodio granulado
Sulfuro de hierro o pirita
IV- PROCEDIMIENTO
Esta prctica ser presentada en un video demostrativo que usted encontrar en el
aula virtual. El reporte se presentar a travs del aula virtual.
A. XIDOS BSICOS
Coger un pedazo de sodio, magnesio y cobre, observar su estado fsico. De
aquellas que cambiaron al ponerse en contacto son el medio ambiente,
cmo cambiaron?, qu se form?, realizar reacciones qumicas. Aquellas
sustancias que no cambiaron aparentemente, someterlas a la llama de un
mechero Cmo cambiaron?, qu se form?, realizar reacciones qumicas.
Nombrar los productos obtenidos.
B. HIDRXIDOS
Introducir el sodio del procedimiento anterior a un tubo de ensayo que contenga agua, esperar que reaccione, comprobar la sustancia formada con papel de tornasol y fenolftalena. Escribir, balancear las reacciones qumicas y
dar nombre al producto.
Tome un poco de xido de magnesio y combnelo con 20 ml de agua en un
vaso de precipitados. Agite y deje en reposo, comprobar el producto obtenido con papel de tornasol y solucin alcohlica de fenolftalena.
C. XIDOS CIDOS O ANHDRIDOS
Encienda un pedazo de azufre. Huela ligeramente el gas que se desprende y apague el azufre, identificar la sustancia formada. Realizar reacciones qumicas y nombrar.
D. CIDOS OXCIDOS
En un matraz que contenga un poco de agua, introduzca en una cuchara de
combustin, un trozo de azufre encendido. Tape bien. Cuando termine la
combustin del azufre y se obtenga suficiente gas extraiga la cuchara, tape y
agite el matraz. Qu sucede con el gas que est en el matraz?, compruebe
los resultados con papel de tornasol y solucin alcohlica de fenolftalena.
E. CIDOS HIDRCIDOS
En un equipo sulfhidricador hacer reaccionar pirita o sulfuro de hierro (FeS),
luego adicionar cido clorhdrico, esperar que reaccione, si no lo hace someter a
calentamiento, recibir el gas obtenido en un vaso de precipitados con agua, comprobar la sustancia obtenida con papel de tornasol. Escribir las reacciones qumicas.
F. SALES HALOIDEAS
En un tubo de ensayo que contenga al hidrxido de sodio (0.2 g) previamente disuelto en agua, sulfhidricar, observar el color del precipitado, escribir,
balancear la reaccin qumica y nombrar el producto formado.
Neutralice una solucin diluida de cido clorhdrico con solucin de hidrxido de sodio en un vaso de pp. Ponga un poco de esta solucin neutralizada en una cpsula y evapore a sequedad, hasta que deje residuo slido y
Bibliografa
19
20
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
luego observe el color y pruebe el sabor de este residuo. Escribir reacciones
qumicas y nombrar el producto obtenido.
G. SALES OXISALES
Anotaciones
En un tubo de ensayo que contenga hidrxido de magnesio (0.2 g), previamente disuelto en agua agregar gota a gota de cido sulfrico hasta observar
la formacin del precipitado, realizar reacciones qumicas y nombrar el producto formado (precipitado).
REPORTE N 1: FUNCIONES INORGNICAS
INSTRUCCIONES:
Completa la informacin requerida e informa de manera clara y concreta los siguientes
aspectos relacionadas con la prctica.
1. Reporte de resultados. (12ptos)
COMPLETE LAS SIGUIENTES
ECUACIONES
EXP.
Na + O2
Mg + O2
A
+1
Cu+ O2
+2
Cu+ O2
Na2O + H2O
B
MgO + H2O
+4
S + O2
C
+6
S + O2
FeS + HCl
H2S + NaOH
F
HCl + NaOH
H2SO4 + Ca ( OH)2
G
FUNCIN INORGNICA
Y NOMENCLATURA DEL
PRODUCTO PRINCIPAL
OBSERVACIONES
ACTIVIDAD
Desarrollo
de contenidos
2. Escriba sus conclusiones con respecto a la prctica realizada. (8 ptos.)
Lecturas
seleccionadas
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Glosario
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Recordatorio
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------Diagrama
Objetivos
Desarrollo
de contenidos
Actividades
Inicio
ACTIVIDAD N 2:
Autoevaluacin
PRCTICA DE LABORATORIO N 2: PREPARACION DE SOLUCIONES
I OBJETIVOS:
Lecturas
seleccionadas
Bibliografa
Prepara
soluciones en diferentes concentraciones fsicas y qumicas
Glosario
Aplica frmulas y realiza clculos para determinar concentraciones de las soluciones y la cantidad de reactivos a utilizarce.
Recordatorio
Valora el trabajo grupal y realiza su trabajo en forma cientfica respetando las
normas de seguridad e higiene.
Anotaciones
II. FUNDAMENTO TERICO:
Las soluciones son mezclas homogneas de dos o ms sustancias que pueden ser lquidas ejm: (agua y alcohol), slidas ejm: Acero (Fe y carbono) y gaseosas ejm:(aire).
Los componentes de una solucin o disolucin son el soluto y el solvente o disolvente.
El componente que est presente en mayor cantidad se llama disolvente y el que est en
menor cantidad se llama soluto.
Los componentes de una solucin, independientemente del estado fsico en que se
encuentren, no pueden ser separados por filtracin ni por centrifugacin debido al
tamao submicroscpico de sus partculas que estn distribuidas de manera uniforme
en toda la mezcla.
Concentracin de soluciones
La concentracin de soluciones la determina la cantidad de soluto dispersada en
la solucin, a medida que aumente la proporcin del soluto tendremos soluciones
ms concentradas que se expresan en unidades fsicas y qumicas. As tenemos:
Solucin diluida: Donde el soluto est presente en una mnima proporcin.
Solucin saturada: Es la cantidad mxima de soluto que el solvente acepta. Por
ejemplo 100 g de agua a 0C son capaces de disolver hasta 37.5 g de NaCl, como se
muestra en el siguiente grfico.
Anotaciones
Bibliografa
21
22
Actividades
Autoevaluacin
Glosario
Bibliografa
ACTIVIDAD
Solucin sobresaturada: Se da cuando el soluto se presenta en mayor proporcin
que la saturacin. Por ejemplo si se disuelven a 0C, 40 g de NaCl en 100g de agua.
Anotaciones
Soluciones de concentracin conocida: Son aqullas en las que se conoce el contenido de soluto respecto a la cantidad de disolvente o de solucin. En la prctica
veremos, soluciones porcentuales y molaridad. Las frmulas se encuentran en la
parte terica de este captulo.
III. MATERIALES Y REACTIVOS
MATERIALES.
1 jarra de plstico o vidrio que presente graduaciones hasta un litro
1 cuchara
1 balanza de 0-500 g
REACTIVOS
Sal de cocina (NaCl)
Etanol puro 96 (C2H5OH)(alcohol de caa)
Bicarbonato de sodio (NaHCO3) (se encuentra en farmacias)
Azcar
IV- PROCEDIMIENTO
Esta prctica ser realizada por los estudiantes.
Experimento 1:
Disuelva 10 g de sal en una jarra y enrase (afore) con agua hasta un volumen de 100
ml. Determine su concentracin porcentual y la cantidad de solvente en ml.
Experimento 2:
Prepare 500 ml de una solucin azucarada al 30%, Determine la cantidad de soluto
en g y solvente ml.
Experimento 3:
Prepare una solucin al 25% utilizando 50 ml de etanol (caa pura). Determinar la
cantidad de la solucin en ml y la cantidad de disolvente en ml.
Experimento 4:
Prepare 1 litro de una solucin de bicarbonato de sodio al 0.1M. Determinar la
cantidad de soluto en g y solvente en ml.
Experimento 5:
Prepare medio litro de una solucin alcohlica al 2M, utilizando alcohol de caa.
Determinar la cantidad de soluto en ml y la cantidad de solvente en ml.
Experimento 6:
Prepare 300 ml de una solucin salina al 1.5M. Determine la cantidad de soluto en
g y la cantidad de solvente en ml.
ACTIVIDAD
Desarrollo
de contenidos
REPORTE N 2: PREPARACIN DE SOLUCIONES
INSTRUCCIONES:
Lecturas
seleccionadas
Glosario
Recordatorio
Anotaciones
Completa la informacin requerida e informa de manera clara y concreta los siguientes
aspectos relacionadas con la prctica.
1. Reporte de resultados: Incluir unidades (12 ptos)
Exp.
Concentracin
Cantidad
de
solucin o
disolucin
Cantidad
de
solvente o
disolvente
Cantidad.
de soluto
Actividades Autoevaluacin
QUMICA
GENERAL MANUAL AUTOFORMATIVO
Clculos
2. Escriba sus conclusiones con respecto a la prctica realizada. (8 ptos.)
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Bibliografa
23
You might also like
- DETERMINACION DEL CONTENIDO DE ÁCIDO ACÉTICO EN VINAGRE MEDIANTE TITULACIÓN POTENCIOMETRICA - Practica N°7Document14 pagesDETERMINACION DEL CONTENIDO DE ÁCIDO ACÉTICO EN VINAGRE MEDIANTE TITULACIÓN POTENCIOMETRICA - Practica N°7leisy100% (4)
- Transferencia de Calor en CalderasDocument27 pagesTransferencia de Calor en Calderassssss rrrr100% (5)
- Grasas lubricantes: características y tiposDocument18 pagesGrasas lubricantes: características y tiposGustavo VargasNo ratings yet
- Practica Electrolitos y No ElectrolitosDocument5 pagesPractica Electrolitos y No ElectrolitosFrancisco Perez67% (3)
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Título Del ArtículoDocument4 pagesTítulo Del ArtículoGian InsiteNo ratings yet
- Título Del ArtículoDocument4 pagesTítulo Del ArtículoGian InsiteNo ratings yet
- Cursillo de LubrigrasasDocument1 pageCursillo de LubrigrasasLuis E. RocaNo ratings yet
- Título Del ArtículoDocument4 pagesTítulo Del ArtículoGian InsiteNo ratings yet
- 000011111Document1 page000011111Luis E. RocaNo ratings yet
- HoyeDocument1 pageHoyeLuis E. RocaNo ratings yet
- 00001111Document1 page00001111Luis E. RocaNo ratings yet
- Título Del ArtículoDocument4 pagesTítulo Del ArtículoGian InsiteNo ratings yet
- En La Ficha InsertaseDocument1 pageEn La Ficha InsertaseLuis E. RocaNo ratings yet
- Mante 0001Document1 pageMante 0001Luis E. RocaNo ratings yet
- 0000111Document1 page0000111Luis E. RocaNo ratings yet
- En La Ficha InsertaruuuuDocument1 pageEn La Ficha InsertaruuuuLuis E. RocaNo ratings yet
- 00001Document1 page00001Luis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaAAAAADocument1 pageEn La Ficha InsertaruuuuaAAAAALuis E. RocaNo ratings yet
- En La Ficha InsertaruuuDocument1 pageEn La Ficha InsertaruuuLuis E. RocaNo ratings yet
- 000011Document1 page000011Luis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaAADocument1 pageEn La Ficha InsertaruuuuaAALuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaAAAADocument1 pageEn La Ficha InsertaruuuuaAAAALuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaAAAAADocument1 pageEn La Ficha InsertaruuuuaAAAAALuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuDocument1 pageEn La Ficha InsertaruuuuLuis E. RocaNo ratings yet
- En La Ficha InsertaruuDocument1 pageEn La Ficha InsertaruuLuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaAAADocument1 pageEn La Ficha InsertaruuuuaAAALuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaADocument1 pageEn La Ficha InsertaruuuuaALuis E. RocaNo ratings yet
- En La Ficha Insertar1uDocument1 pageEn La Ficha Insertar1uLuis E. RocaNo ratings yet
- En La Ficha InsertaruuuuaDocument1 pageEn La Ficha InsertaruuuuaLuis E. RocaNo ratings yet
- En La Ficha InsertaruDocument1 pageEn La Ficha InsertaruLuis E. RocaNo ratings yet
- Diagrama Termólisis - PirólisisDocument3 pagesDiagrama Termólisis - PirólisisLaura MuñozNo ratings yet
- Objetivos y características de la química generalDocument7 pagesObjetivos y características de la química generalRosa MarquezNo ratings yet
- Especificaciones Tecnicas de Pastillas DPDDocument2 pagesEspecificaciones Tecnicas de Pastillas DPDEsteili Duran MendozaNo ratings yet
- Tech DictionaryDocument34 pagesTech DictionarymartingutierrezcoyleNo ratings yet
- Evolución de Envases de La Marca AlicorpDocument10 pagesEvolución de Envases de La Marca AlicorpRonaldNo ratings yet
- Contenido Semana 8 (090622)Document25 pagesContenido Semana 8 (090622)Mario DubóNo ratings yet
- Centro TermicoDocument12 pagesCentro TermicoElisa BaenaNo ratings yet
- Yodo MetalicoDocument3 pagesYodo MetalicoAlexis Vasquez Alcantara100% (1)
- Trabajabilidad, Cono de AbransDocument25 pagesTrabajabilidad, Cono de AbransChristian C. Zapata HuertasNo ratings yet
- Guía N°3 - Tratamientos Térmicos - UtpDocument4 pagesGuía N°3 - Tratamientos Térmicos - UtpPieroo SantistebanNo ratings yet
- Guia 3 AnalisisDocument4 pagesGuia 3 AnalisisMaria VargasNo ratings yet
- MVC-PET-02-002 Preparacion de CeboDocument4 pagesMVC-PET-02-002 Preparacion de CeboLeo Agurto BautistaNo ratings yet
- Padron Ps Rme Recoleccion y Transporte 19072022Document61 pagesPadron Ps Rme Recoleccion y Transporte 19072022German GarciaNo ratings yet
- Las Diversas Aplicaciones de La CarboximetilcelulosaDocument42 pagesLas Diversas Aplicaciones de La CarboximetilcelulosaYitzhar LealNo ratings yet
- Materials 13 05134Document28 pagesMaterials 13 05134Brayan LuisNo ratings yet
- Ejemplos de ViscosidadDocument2 pagesEjemplos de ViscosidadOmar Baez RomeroNo ratings yet
- ProgramaDocument2 pagesProgramaJonathan LargoNo ratings yet
- MatrizDocument27 pagesMatrizbernardoNo ratings yet
- Rocas Sedimentarias No ClasticasDocument53 pagesRocas Sedimentarias No ClasticashammjosenNo ratings yet
- El Ensayo de La Gota de Evans 2Document6 pagesEl Ensayo de La Gota de Evans 2Armando Percy Cartagena LazoNo ratings yet
- Fluidos de PerforacionDocument9 pagesFluidos de Perforacionkeiner fernandezNo ratings yet
- Diapositivas - EspesadoresDocument7 pagesDiapositivas - Espesadoresjorge alberto ortiz barretoNo ratings yet
- PC2 Quim AsesDocument27 pagesPC2 Quim AsesLoida Salvatierra PantojaNo ratings yet
- CEPEP Evaluacion SocIal de Proyectos Residuos SolidosDocument42 pagesCEPEP Evaluacion SocIal de Proyectos Residuos Solidoscova5609No ratings yet
- Impresiones DefinitivasDocument148 pagesImpresiones Definitivasjuancarlos929No ratings yet
- Fichas-Tecnicas-Cableado Estructurado - Norman.Document4 pagesFichas-Tecnicas-Cableado Estructurado - Norman.Alexis FloresNo ratings yet
- Efecto de Las Fibras de Polipropileno para ConcretosDocument151 pagesEfecto de Las Fibras de Polipropileno para ConcretosLuis Ricardo Ramirez ChavezNo ratings yet