Professional Documents
Culture Documents
Aula Bioquimica
Uploaded by
Lucas Paes BarretoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Aula Bioquimica
Uploaded by
Lucas Paes BarretoCopyright:
Available Formats
Bioqumica
Programa do curso:
1. Introduo Bioqumica: 1.1 Biomolculas 1.1.1
Composio 1.1.2 Grupos funcionais e
propriedades qumicas
2. Bioqumica da digesto e absoro 2.1 Glicdios
2.2 Lipdios 2.3 Aminocidos
3. Oxidaes biolgicas 3.1 Compostos de alta
energia 3.2 Ciclo de Krebs 3.3 Cadeia respiratria
4. Estudo dos Carboidratos: 4.1 Classificao,
estrutura e isomeria; 4.2 Metabolismo dos
carboidratos.
5. Estudo dos Lipdios: 5.1. Estrutura e classificao
dos principais cidos graxos; 5.2. Componentes dos
Lpidios. 5.3. Propriedades qumicas dos Lpidios 5.4.
Metabolismo de Lipidios.
6. Estudo dos Aminocidos e Protenas 6.1. Qumica
dos Aminocidos: Aminocidos naturais, grupamentos
qumicos nas cadeias laterais, estruturas D e L,
propriedades. 6.2. Qumica das protenas: estrutura e
conformao.
7. Enzimas
BSICA:
MURRAY, R. K.; GRANNER, D. K. G. ; MAYES, P. A.; V. W.
HARPER. Bioqumica. 9. ed. So Paulo: Atheneu, 2002.
860 p.
CHAMPE, Pamela C.; HARVEY, Richard A.; BIOQUMICA
ILUSTRADA, 2 edio, Porto Alegre, Artes Mdicas,
1997.
LEHNINGER, A. L.; NELSON, K. Y. Princpios de
Bioqumica. 4. ed. So Paulo: Sarvier, 2006. VOET,
Donald; VOET, Judith G; PRATT, Charlote W.
Fundamentos de bioqumica. Porto Alegre: Artmed,
2000.
COMPLEMENTAR:
DEVLIN, T.M. Manual de bioqumica com correlaes
clnicas. So Paulo: Edgard Blucher, 1998.
MARZZOCCO, A. e TORRES, B.B. Bioqumica bsica.
Rio de Janeiro: Guanabara Koogan, 1999. HOUSTON,
Michael. Princpios de bioqumica para a cincia do
exerccio. 3.ed. So Paulo: Roca, 2008.
SOLOMONS, TW Graham; FRYHLE, Craig B. Qumica
Orgnica. Vol 2. 8 ed. Rio de Janeiro, 2006
Introduo a bioqumica
A bioqumica uma cincia que
estuda principalmente a qumica dos
processos biolgicos que ocorrem
em todos os seres vivos.
A bioqumica est voltada
principalmente para o estudo da
estrutura, funo e reaes de
componentes celulares como:
protenas,
carboidratos,
lipdios,
cidos nuclicos
O tomo
Antigamente: indivisvel
Recentemente:sabe-se que composto por trs
partculas:
o eltron,
o prton e
o nutron.
Outras subpartculas
Estas partculas localizam-se em duas regies
do tomo:
o ncleo atmico (prtons e nutrons),
a eletrosfera (eltrons).
O tomo cem mil vezes maior que seu ncleo,
e sua estrutura interna pode ser considerada ,
para efeitos prticos, oca; pois para encher
todo este espao vazio de prtons e nutrons
(ou ncleos) necessitaramos de um bilho de
milhes de ncleos...
Modelo de Bohr
tomo
Carga eltrica
Natureza Valor relativo Massa Relativa
Prton Positiva+1 1
Nutron No existe 0
Eltron Negativa -1 1/1836
Camadas eletrnicas
Os eltrons esto distribudos em camadas ou nveis
de energia:
Ncleo
Camada
K L M N O P Q
1 2 3 4 5 6 7
Nvel: Nmero mximo de eltrons nas camadas ou nveis
de energia:
K L M N O P Q
2 8 18 32 32 18 2
Subnveis de energia
As camadas ou nveis de energia so formados de
subcamadas ou subnveis de energia, designados
pelas letras s, p, d, f.
O nmero de eltrons de um tomo identifica o elemento qumico
Hidrognio Carbono
Sdio Cloro
Como os elementos qumicos se combinam
para formar os compostos qumicos?
Ligaes qumicas
Inicas :Transferncia de eltrons
Covalentes: Compartilhamento de eltrons
Estabilidade das molculas orgnicas
Interaes qumicas fortes:
Inica
Covalente
Interaes fracas
Interaes de van der Waals:
dipolo dipolo atrao eletrosttica entre os dipolos
opostos.
dipolo-dipolo induzido distorcer a distribuio de
carga eltrica em outras molculas vizinhas
Disperso molculas apolares
Ligao fora magnitude (KJ/mol)
Qumica
covalente 100-1000
inica 100-1000
Intermolecular
on-dipolo
dipolo-dipolo
Disperso
ligao-H
1-70
0.1-10
0.1-2
10-40
Ponte de hidrognio
so interaes que ocorrem
entre o tomo de
hidrognio e dois ou mais
tomos, de forma que o
hidrognio sirva de elo
entre os tomos com os
quais interagem.
You might also like
- O Método Natural de Comênio para EnsinoDocument2 pagesO Método Natural de Comênio para EnsinoDaniel LeãoNo ratings yet
- PassionistasDocument15 pagesPassionistasTiagoNo ratings yet
- O Envelhecimento e o Coração: As Valvas: The Elderly and Heart: ValvesDocument2 pagesO Envelhecimento e o Coração: As Valvas: The Elderly and Heart: ValvesHermeson OliveiraNo ratings yet
- Gervão-Roxo - Stachytarpheta Jamaicensis (L.) Vahl. - Ervas Medicinais - Ficha Completa IlustradaDocument9 pagesGervão-Roxo - Stachytarpheta Jamaicensis (L.) Vahl. - Ervas Medicinais - Ficha Completa IlustradaViam prudentiaeNo ratings yet
- Atividade Avaliativa de Recuperação ParalelaDocument7 pagesAtividade Avaliativa de Recuperação ParalelaScheila Brito PereiraNo ratings yet
- Tabelas de frequência para análise de dadosDocument4 pagesTabelas de frequência para análise de dadospaulacpgouveiaNo ratings yet
- 2 - Conceitos e Tipos de Constituição PDFDocument6 pages2 - Conceitos e Tipos de Constituição PDFleoNo ratings yet
- Funções quadráticasDocument3 pagesFunções quadráticasalmeida.agostinho8406No ratings yet
- Conhecendo Pelo Dia NascimentoDocument22 pagesConhecendo Pelo Dia NascimentoJoelbsom Martins BarbosaNo ratings yet
- Conteudo Simulado - 8º Ano - 2024Document2 pagesConteudo Simulado - 8º Ano - 2024Colégio Aspecto EducaçãoNo ratings yet
- Linguagem afirmativa mais eficazDocument3 pagesLinguagem afirmativa mais eficazDanilo CruzNo ratings yet
- SH Microbiologia e ParasitologiapdfDocument33 pagesSH Microbiologia e Parasitologiapdfweslley.liimah23No ratings yet
- Correção - VitinhoDocument4 pagesCorreção - VitinhoPeter BoweryNo ratings yet
- Balada Da Praia Dos CãesDocument11 pagesBalada Da Praia Dos CãesSandra SantosNo ratings yet
- Estratégia OrganizacionalDocument27 pagesEstratégia OrganizacionalEduardoNo ratings yet
- História da Arte e TecnologiaDocument36 pagesHistória da Arte e TecnologiaLuiz FernandoNo ratings yet
- Orientação nutricional para Doença de CrohnDocument4 pagesOrientação nutricional para Doença de CrohnKaylane CardosoNo ratings yet
- CO_banco_questõesDocument10 pagesCO_banco_questõesAurea Cardoso100% (1)
- A Glandula Pineal PDFDocument30 pagesA Glandula Pineal PDFAnonymous iwuIYn100% (4)
- Cálculo de limites usando propriedadesDocument7 pagesCálculo de limites usando propriedadesAbgail PinheiroNo ratings yet
- Avaliação - Dança Do Sagrado FemininoDocument5 pagesAvaliação - Dança Do Sagrado FemininocasonatofabiolaNo ratings yet
- A Ética Nas OrganizaçõesDocument37 pagesA Ética Nas OrganizaçõesAdriano Nelson DjiveNo ratings yet
- 7 Chakras VibraçõesDocument1 page7 Chakras VibraçõesHenriqueNo ratings yet
- Resumo Extremidades AtualizadoDocument36 pagesResumo Extremidades AtualizadoAndrey AlvesNo ratings yet
- Fases Da Doença de Alzheimer - Wania AndradeDocument5 pagesFases Da Doença de Alzheimer - Wania AndradeWania AndradeNo ratings yet
- Estatística ficha exercícios resolvidosDocument17 pagesEstatística ficha exercícios resolvidosArsénio Sadique Aualo100% (1)
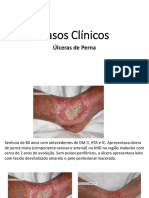
- AULA 15 - Casos Clínicos Úlceras de PernaDocument24 pagesAULA 15 - Casos Clínicos Úlceras de PernaManuel E NeuzaNo ratings yet
- 6 - Tecnologias No EnsinoDocument34 pages6 - Tecnologias No EnsinoLeonardo SouzaNo ratings yet
- Relatório Da Pesquisa - Retorno Às Aulas - Maio - 2020Document8 pagesRelatório Da Pesquisa - Retorno Às Aulas - Maio - 2020MetropolesNo ratings yet
- Revisão2 1ºanoDocument1 pageRevisão2 1ºanoJoão LemosNo ratings yet