Professional Documents
Culture Documents
Teoria Cuantica Del Atomo
Uploaded by
Carlos Alexander L. Hernandez100%(2)100% found this document useful (2 votes)
1K views2 pagesCopyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
100%(2)100% found this document useful (2 votes)
1K views2 pagesTeoria Cuantica Del Atomo
Uploaded by
Carlos Alexander L. HernandezCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 2
TEORIA CUANTICA DEL ATOMO
ORGENES DE LA TEORA CUNTICA
La teora cuntica fue propuesta en primer lugar por Max Planck en 1900, para explicar la
radiacin de un cuerpo caliente. Hoy en da se sabe que la teora cuntica es una teora general
que se aplica a todas las interaciones de la materia con la energa. Esta teora se basa en distintos
postulados.
Los tomos y las molculas slo pueden existir en ciertos estados, que se caracterizan por una
cierta energa. Cuando un tomo o molcula cambia de estado, debe absorber o emitir la cantidad
exacta para ir a dicho estado.
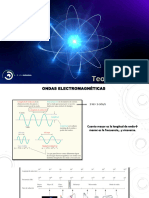
Cuando los tomos o molculas absorben o emiten luz en el proceso de cambiar sus energas la
longitud de onda de la luz est relacionada con el cambio de energa.
Los estados de energa, de tomos o molculas se pueden describir por una serie de nmeros
llamados nmeros cunticos
MODELO ATMICO DE BOHR
Niels Bohr propuso un modelo atmico basado en tres postulados:
En un tomo el electrn slo puede tener ciertos estados de movimiento definidos y estacionarios,
en cada uno de ellos tiene una energa fija y determinada.
En cualquiera de esos estados, el electrn se mueve describiendo rbitas circulares alrededor del
ncleo. Slo son posibles, aquellas rbitas en las que el momento angular del electrn en ellas es
un multiplo entero de h/(2pi).
Un electrn puede saltar de una rbita a otra absorbiendo ( si va hacia una rbita ms exterior) o
emitiendo (en caso contrario) un cuanto de radiacin electromagntica de energa igual a la
diferencia existente entre los estados de partida y de llegada.
NMEROS CUNTICOS Y NIVELES DE ENERGA.
Schrdinger encontr que el electrn del tomo de hidrgeno se poda describir por cuatro
nmeros cunticos, n, l, ml, s. El primer nmero cuntico el n, nos fija la energa del electrn, y se
denomina n cuntico principal. El l, nos describe la forma de la nube electrnica asociada a un
electrnica asociada a un electrn y se denomina n cuntico secundario. Los nmeros cunticos n
y l estn relacionados entre s, y l slo puede tomar valores desde 0 hasta (n-1). El n l, sirve para
indicar el subnivel de manera que:
Nmero cuntico l 0 1 2 3
Tipo de subnivel s p d f
El nmero cuntico magntico ml nos dice cmo est orientada la nube electrnica que rodea al
ncleo. Toma cualquier valor entero desde -l , hasta +l pasando por cero. El spn s, es el nmero
cuntico asociado al giro del electrn, alrededor de s mismo. Los valores que toma son + (1/2), -
(1/2).
DISTRIBUCIN DE LOS ELECTRONES EN LOS TOMOS. Los e- dentro del tomo se pueden distribuir
en niveles principales, subniveles y orbitales. La manera de mostrar cmo se distribuyen los
electrones en un tomo, es a travs de la configuracin electrnica. El orden en el que se van
llenando los niveles es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. Pero este orden de llenado debe de cumplir la
regla de Hund, que dice: " el orden de llenado en un subnivel es aquel en el que hay un mximo n
de orbitales semillenos. Los electrones de estos orbitales tienen los espines paralelos.
You might also like
- Números Cuánticos PDFDocument25 pagesNúmeros Cuánticos PDFJorgeNo ratings yet
- Tema 1.el Atomo Mecano-CuánticoDocument9 pagesTema 1.el Atomo Mecano-CuánticojavierNo ratings yet
- QUIMICA CinvestavDocument107 pagesQUIMICA CinvestavBerenice Acevedo HerreraNo ratings yet
- Modelo Atómico de BohrDocument13 pagesModelo Atómico de BohrCarlos SoberanesNo ratings yet
- TEORIA CUANTICA Configuracion ElectronicaDocument17 pagesTEORIA CUANTICA Configuracion ElectronicaMaría elizabeth Díaz DíazNo ratings yet
- Configuración ElectrónicaDocument10 pagesConfiguración ElectrónicaJaime Borja SalazarNo ratings yet
- Quimica Inorganica - Config ElectronicaDocument2 pagesQuimica Inorganica - Config ElectronicaMaria Florencia AlbarelloNo ratings yet
- Clase 3 CienciasQuímica Global 2023 PresentaciónDocument25 pagesClase 3 CienciasQuímica Global 2023 PresentaciónMillaray BarrosNo ratings yet
- Guia de Estudio Configuración ElectronicaDocument10 pagesGuia de Estudio Configuración ElectronicaPaula R. TarifeñoNo ratings yet
- Atomo y Estructura AtomicaDocument12 pagesAtomo y Estructura AtomicaKarlenys Mogollon0% (1)
- Capitulo 2 - Quimica - Estructura Electronica PDFDocument17 pagesCapitulo 2 - Quimica - Estructura Electronica PDFAlex Aguirre ParedesNo ratings yet
- Apuntes de Estructura Atómica. Tercera ParteDocument17 pagesApuntes de Estructura Atómica. Tercera ParteBrandon PaichoNo ratings yet
- Nc3bameros Cuc3a1nticos y Configuracic3b3n Electrc3b3nicaDocument5 pagesNc3bameros Cuc3a1nticos y Configuracic3b3n Electrc3b3nicaYocelin ValenciaNo ratings yet
- Modelo Atomico de La Mecanica Cuantica OndulatoriaDocument13 pagesModelo Atomico de La Mecanica Cuantica Ondulatoriapnada007100% (2)
- Sesion 2 (T)Document44 pagesSesion 2 (T)Piero Aaron SolanoNo ratings yet
- Guia Modelo Mecano Cuantico y Configuracion ElectronicaDocument8 pagesGuia Modelo Mecano Cuantico y Configuracion ElectronicaLily baeza galvezNo ratings yet
- 7 Taller de Quimica Modelos AtomicosDocument3 pages7 Taller de Quimica Modelos Atomicosfull megasNo ratings yet
- Guía - 02 - Números Cuánticos y Configuración ElecrónicaDocument13 pagesGuía - 02 - Números Cuánticos y Configuración ElecrónicaYayo Pizarro AlarconNo ratings yet
- Los Números Cuánticos PDFDocument30 pagesLos Números Cuánticos PDFMilma CermeñoNo ratings yet
- Materia y Energía. Estructura Atómica. (Segunda Parte) .Document25 pagesMateria y Energía. Estructura Atómica. (Segunda Parte) .Fabricio RodríguezNo ratings yet
- Configuración ElectrónicaDocument7 pagesConfiguración ElectrónicaDaniela CárcamoNo ratings yet
- Orbital EsDocument27 pagesOrbital EsMonica OramasNo ratings yet
- MODELO MECANICO CUANTICO DEL ATOMO fH76bT5Document6 pagesMODELO MECANICO CUANTICO DEL ATOMO fH76bT5Natha GarciaNo ratings yet
- Estructura ElectronicaDocument4 pagesEstructura ElectronicaAnonymous c9vSsdBPNo ratings yet
- Numeros Cuanticos QuimicaDocument3 pagesNumeros Cuanticos QuimicaVictor RodriguezNo ratings yet
- Mecánica Cuántica y Orbitales AtómicosDocument9 pagesMecánica Cuántica y Orbitales AtómicosBrenda CaroNo ratings yet
- Tema 4. Quimica I - 2018Document28 pagesTema 4. Quimica I - 2018Alex TorresNo ratings yet
- Números CuánticosDocument3 pagesNúmeros CuánticosAshly Gianella Cameron HanncoNo ratings yet
- Modelo Atómico de La Mecánica Cuántica OndulatoriaDocument13 pagesModelo Atómico de La Mecánica Cuántica OndulatoriaPaúl MartínezNo ratings yet
- Modelo Mecanico Cuántico Del Átomo Semana 2Document15 pagesModelo Mecanico Cuántico Del Átomo Semana 2Neyib fadul100% (1)
- Configuración Electrónica QUIMICA TAREADocument3 pagesConfiguración Electrónica QUIMICA TAREAGibran MendozaNo ratings yet
- El Átomo MecanoDocument3 pagesEl Átomo Mecanovalente llenque sanchezNo ratings yet
- Guía Mecánica CuánticaDocument5 pagesGuía Mecánica CuánticaMarcos Anguita SNo ratings yet
- RESUMENDocument1 pageRESUMENcastrotovarangel22No ratings yet
- Examen 2 de QuimicaDocument7 pagesExamen 2 de QuimicaRicardo SantiagoNo ratings yet
- 8° Basico PPT Tema 1 - Los Modelos Atomicos Parte 2 1Document42 pages8° Basico PPT Tema 1 - Los Modelos Atomicos Parte 2 1Cristobal VarasNo ratings yet
- Modelos AtómicosDocument4 pagesModelos AtómicosJose Ignacio Campos RojasNo ratings yet
- Cap. 6. Estructura Electrónica ÁtomosDocument54 pagesCap. 6. Estructura Electrónica ÁtomosMarcia JaraNo ratings yet
- Guía Fisicoquímica Septimo (2126) PDFDocument3 pagesGuía Fisicoquímica Septimo (2126) PDFRogerus AntoniusNo ratings yet
- Guía de Trabajo Configuración Electrónica I Medio QuímicaDocument5 pagesGuía de Trabajo Configuración Electrónica I Medio QuímicaprofesorcienciaslabNo ratings yet
- Unidad 3 Parte 2estructura Atómica - 2Document11 pagesUnidad 3 Parte 2estructura Atómica - 2Angel AcuñaNo ratings yet
- 1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Document6 pages1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Julio Eduardo CiodaroNo ratings yet
- Tema 2Document23 pagesTema 2EustaquioNo ratings yet
- Teorías Atómicas de Niels Bohr, Sommerfeld, SchrodingerDocument6 pagesTeorías Atómicas de Niels Bohr, Sommerfeld, SchrodingerBRANDON SANCHEZNo ratings yet
- El Modelo Atomico de BohrDocument3 pagesEl Modelo Atomico de BohrFrida LlerenaNo ratings yet
- Modelos AtómicosDocument8 pagesModelos AtómicosLeilaNo ratings yet
- Modelo Atómico ActualDocument4 pagesModelo Atómico ActualLeo SNo ratings yet
- Resumen de Quimica General UTNDocument45 pagesResumen de Quimica General UTNFran RivelliNo ratings yet
- Modelo Atomico de BohrDocument15 pagesModelo Atomico de BohrAlexander MoranNo ratings yet
- Modelo Atomico ActualDocument6 pagesModelo Atomico ActualDiegoNo ratings yet
- Mecanica CuanticaDocument13 pagesMecanica CuanticaYoSoyChinoNo ratings yet
- 3-Teoría Cuántica-VfinalDocument48 pages3-Teoría Cuántica-VfinaljuanixgenoNo ratings yet
- Presentación UC4Document43 pagesPresentación UC4Älëxąndër SPNo ratings yet
- Atomo CuanticoDocument9 pagesAtomo CuanticoVilchis Granados Axel MaximilianoNo ratings yet
- MODELO MECANICO CUANTICO DEL ATOMO fH76bT5Document9 pagesMODELO MECANICO CUANTICO DEL ATOMO fH76bT5Natha GarciaNo ratings yet
- Modelo Atomico de BohrDocument14 pagesModelo Atomico de BohrJackson RamirezNo ratings yet
- Estructura Atómica FichaDocument2 pagesEstructura Atómica FichaProf. Víctor M. VitoriaNo ratings yet
- Teorías AtomicasDocument39 pagesTeorías Atomicaspaola novoaNo ratings yet
- Modelo Nuclear Del Atomo.Document44 pagesModelo Nuclear Del Atomo.Joselyn OrtegaNo ratings yet
- 30 Palabras FrancesasDocument3 pages30 Palabras FrancesasCarlos Alexander L. HernandezNo ratings yet
- Quienes Fueron Los Principales Actores Del Proceso de Independencia en El SalvadorDocument8 pagesQuienes Fueron Los Principales Actores Del Proceso de Independencia en El SalvadorCarlos Alexander L. HernandezNo ratings yet
- Órganos VestigialesDocument2 pagesÓrganos VestigialesCarlos Alexander L. HernandezNo ratings yet
- Historia de La Teoria Juridica Del DelitoDocument2 pagesHistoria de La Teoria Juridica Del DelitoCarlos Alexander L. HernandezNo ratings yet
- Revolución TecnológicaDocument7 pagesRevolución TecnológicaCarlos Alexander L. Hernandez0% (1)
- AYLLUDocument2 pagesAYLLUCarlos Alexander L. Hernandez100% (1)
- Reproducción Asexual en MicrorganismosDocument6 pagesReproducción Asexual en MicrorganismosCarlos Alexander L. HernandezNo ratings yet
- Simbolos Patrios de El SalvadorDocument2 pagesSimbolos Patrios de El SalvadorCarlos Alexander L. Hernandez78% (9)
- Lista de Desastres Naturales en El SalvadorDocument2 pagesLista de Desastres Naturales en El SalvadorCarlosNorio81% (21)
- Inscripcion Ciex El SalvadorDocument2 pagesInscripcion Ciex El SalvadorCarlos Alexander L. Hernandez100% (1)
- El Mechero de Busen - y El Estudio de Las LlamasDocument42 pagesEl Mechero de Busen - y El Estudio de Las LlamasCarlos Alexander L. HernandezNo ratings yet
- Palancas de Primer Segundo y Tercer GradoDocument2 pagesPalancas de Primer Segundo y Tercer GradoCarlos Alexander L. Hernandez0% (1)
- Qué Son Las Señales de Tránsito o Tráfico y para Qué SirvenDocument5 pagesQué Son Las Señales de Tránsito o Tráfico y para Qué SirvenCarlos Alexander L. HernandezNo ratings yet
- Analisis Del Lazarillo de TormesDocument11 pagesAnalisis Del Lazarillo de TormesCarlos Alexander L. HernandezNo ratings yet
- Liberalism oDocument3 pagesLiberalism oCarlos Alexander L. HernandezNo ratings yet
- Acentuacion de Palabras EjerciciosDocument5 pagesAcentuacion de Palabras EjerciciosCarlos Alexander L. Hernandez100% (3)
- Obreros, Sindicatos, Luchas Sociales y Revolución 1945-2000Document3 pagesObreros, Sindicatos, Luchas Sociales y Revolución 1945-2000Carlos Alexander L. Hernandez50% (4)
- En Que Consiste El Desarrollo Complejo de La RealidadDocument1 pageEn Que Consiste El Desarrollo Complejo de La RealidadCarlos Alexander L. Hernandez80% (5)
- Manual Completo CanonDocument11 pagesManual Completo CanonCarlos Alexander L. HernandezNo ratings yet
- Ejemplodeunplandenegocio 130110220354 Phpapp01Document9 pagesEjemplodeunplandenegocio 130110220354 Phpapp01Orlando PeñuñuriNo ratings yet
- LuisDocument2 pagesLuisJuan pabloNo ratings yet
- Programa de Estudios Quimica Basica IpnDocument3 pagesPrograma de Estudios Quimica Basica IpnMarco SENo ratings yet
- Vidrios Metalicos 2Document17 pagesVidrios Metalicos 2Matias perez cofreNo ratings yet
- Unidad 1-Metalurgia FísicaDocument103 pagesUnidad 1-Metalurgia FísicaFrancisco RepulaNo ratings yet
- FormulasDocument15 pagesFormulascompras internetNo ratings yet
- Tema 2 Interaccion Radiacion Materia PDFDocument22 pagesTema 2 Interaccion Radiacion Materia PDFDoris RamzNo ratings yet
- Teoría Atómica de BohrDocument5 pagesTeoría Atómica de BohrCarlos Alamilla RamosNo ratings yet
- Tema 3. Quimica Enlace QuímicoDocument13 pagesTema 3. Quimica Enlace QuímicoNolberto DíazNo ratings yet
- MODULO+3 +MINERALOGIA+GENERALIDADES PPT PpsDocument137 pagesMODULO+3 +MINERALOGIA+GENERALIDADES PPT PpsvaleriaceledoncNo ratings yet
- Tarea 3 FluidosDocument31 pagesTarea 3 FluidosEmerson MayorgaNo ratings yet
- Punto de EbulliciónDocument3 pagesPunto de EbulliciónFabiola Mondocorre PadillaNo ratings yet
- Regla de La Palanca y Dendritas - EvansDocument7 pagesRegla de La Palanca y Dendritas - EvansVANIA EVANSNo ratings yet
- Universidad Popular Autónoma de Veracruz: Examen Primer Parcial Quimica 1Document2 pagesUniversidad Popular Autónoma de Veracruz: Examen Primer Parcial Quimica 1José TapiaNo ratings yet
- Enlace Química: Jade Meza Soto Escuela Profesional Ingeniería de Conservación de Suelos y AguaDocument16 pagesEnlace Química: Jade Meza Soto Escuela Profesional Ingeniería de Conservación de Suelos y AguaJade Meza SotoNo ratings yet
- Ciencias Carlitos Quimica Ultima GuìaDocument10 pagesCiencias Carlitos Quimica Ultima GuìaBenjita NorambuenitaNo ratings yet
- Cuestionario Modelos AtómicosDocument6 pagesCuestionario Modelos AtómicoshectorhernandomsNo ratings yet
- El CristalDocument10 pagesEl CristalAlexander MaldonadoNo ratings yet
- Informe de Laboratorio Practica 11 (Orden de Actividad de Los Metales)Document6 pagesInforme de Laboratorio Practica 11 (Orden de Actividad de Los Metales)Adriana Lucia CusbaNo ratings yet
- Trabajo FinalDocument13 pagesTrabajo FinalBrucer Lee RoncalloNo ratings yet
- Mis Cursos: Comenzado El Estado Finalizado en Tiempo Empleado CalificaciónDocument120 pagesMis Cursos: Comenzado El Estado Finalizado en Tiempo Empleado CalificaciónMaríaNo ratings yet
- Teoria de BandasDocument3 pagesTeoria de BandasWen RiveraNo ratings yet
- Modelo Atómico de SchrödingerDocument2 pagesModelo Atómico de SchrödingerJms NuñezNo ratings yet
- GUIA LABOS 5 y 8 A Ser Realizado FIEEDocument9 pagesGUIA LABOS 5 y 8 A Ser Realizado FIEELuis angelNo ratings yet
- Fuerzas IntermolecularesDocument4 pagesFuerzas IntermolecularesAnna Paula Martinez AvilaNo ratings yet
- Quimica ADocument59 pagesQuimica Aevert german mamani mermaNo ratings yet
- Fisica Del Estado Solido - Maestria en Instrumentacion FisicaDocument2 pagesFisica Del Estado Solido - Maestria en Instrumentacion FisicaAlexander RudenNo ratings yet
- Asignación #5Document4 pagesAsignación #5Kenneth HumesNo ratings yet
- 1 Taller de Biologia Sobre Los Enlaces de Johan Mayorga de 8-1.Document31 pages1 Taller de Biologia Sobre Los Enlaces de Johan Mayorga de 8-1.JOHAN SEBASTIAN MAYORGA ROMERONo ratings yet
- Enlace Valencia Hibridacion PDFDocument23 pagesEnlace Valencia Hibridacion PDFANNo ratings yet
- Repaso IDocument1 pageRepaso IKEVIN PAUL DOMINGUEZ VALENCIANo ratings yet