Professional Documents
Culture Documents
Practica de Capacidad Calorifica
Uploaded by
Armando Darien SantiagoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Practica de Capacidad Calorifica
Uploaded by
Armando Darien SantiagoCopyright:
Available Formats
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
Laboratorio de Fisicoqumica
Biofsica
2IM1
PROFESOR: Jos Enrique Siu
EQUIPO: 3
Integrantes:
Gonzlez Arredondo Fernanda Hitatehui.
Santiago Cruz Grissel.
REPORTE DE LA PRCTICA No.7
CAPACIDAD CALORFICA
2
OBJETIVOS
Aprender a diferenciar un proceso adiabtico de un proceso isotrmico.
Utilizar una tcnica indirecta para calcular capacidades calorficas a presin y volumen
constantes.
Determinar la relacin de capacidades calorficas, conocida como coeficiente adiabtico
() para un gas.
Evaluar la eficiencia de la tcnica en base a los resultados experimentales.
Aplicar la validez de un proceso reversible.
INTRODUCCIN
Primera ley de la termodinmica
Si un sistema se somete a cualquier transformacin cclica, el trabajo producido en el entorno es
igual al calor que fluye desde el entorno. A partir de la primera ley, que relaciona los efectos del
trabajo y el calor observados en el entorno en una transformacin cclica, se deduce la existencia
de una propiedad de estado del sistema, la energa.
La capacidad calorfica (C) de una sustancia es una medida de la elevacin de la temperatura que
se produce cuando la sustancia se calienta. Se expresa en J/C. La capacidad calorfica de 1 mol de
una sustancia se denomina capacidad calorfica molar y se expresa en J/mol C.
Si se hace fluir calor en un gas mantenido a volumen constante, la energa del gas aumenta en la
cantidad de energa suministrada por el flujo de calor. La razn entre el aumento de energa y el
aumento en temperatura del sistema se define como la capacidad calorfica a volumen constante,
C
v
. Mientras que la capacidad calorfica a presin constante es el cambio de entalpa entre el
cambio de temperatura a presin constante.
En un proceso a volumen no se produce trabajo y la distancia promedio entre las molculas
permanece igual. Por tanto la capacidad calorfica es pequea, todo el calor transferido se traduce
en un movimiento catico y se manifiesta mediante un aumento de la temperatura. En un proceso
a presin constante, el sistema se expande contra la presin externa y produce trabajo en el
entorno ambiente; el calor transferido desde el entorno se divide en tres porciones: la primera
parte produce trabajo en el entorno, la segunda proporciona la energa necesaria para separar las
molculas a una distancia mayor y la tercera se traduce en un aumento de la energa del
movimiento catico (se exterioriza mediante un aumento de la temperatura). Para lograr un
aumento de la temperatura de un grado se necesita transferir ms calor en un proceso a presin
constante que uno a volumen constante. En consecuencia C
p
es mayor que C
v
. Razn de capacidad
calorfica = C
p
/ C
v.
Si no hay flujo de calor durante un cambio de estado, se trata de un cambio adiabtico. Una
disminucin de la energa con una disminucin de la temperatura del sistema, por consiguiente, si
se produce trabajo en un cambio adiabtico, la temperatura del sistema disminuye. Para un
3
cambio fijo de volumen, la expansin adiabtica reversible producir la mayor disminucin de
temperatura.
RESULTADOS
El coeficiente adiabtico se obtuvo de la siguiente formula:
= h / h h
1
Donde:
h = es la primera presin, la cual es la diferencia de las columnas de agua.
La P
2
es cuando se nivela y la P
3
es cuando aumenta un poco el nivel de agua, pero debido a que la
presin 3 es muy difcil de medir por tanto el valor de la P
3
es aproximado a h h
1
.
La diferencia(P
1
- P
2
) corresponder a la altura (h) que es la diferencia inicial en el manometro del
parato a utilizar y la diferencia (P
1
P
3
) que correpsonde realmentea la diferencia (P
1
- P
2
) (P
3
P
2
),se leera en el manometro como una altura (h
1
)que es la diferencia (P
3
-
P
2
).
El valor del primer coeficiente adiabtico se obtuvo de la siguiente forma:
= 19.8 / 19.8 5 =1.33
Y asi se obtuvieron todos los valores de .
DISCUSIN DE RESULTADOS
Se obtuvo un coeficiente adiabtico promedio de las 5 lecturas de la altura de la columna de agua
de 1.394 el cual es aceptable comparado con el reportado bibliogrficamente que es de 1.4 y este
valor corresponde al coeficiente adiabtico del aire, el cual puede variar debido a que el aire como
bien se sabe es una mezcla de distintos componentes y nosotros nos encontramos en la zona
norte central lo que hace que el aire que viene del polo norte provoque una condensacin, ya que
se encuentra el aire frio con el aire caliente lo que genera que choquen y se lleve a cabo una
condensacin en forma de lluvia (donde se libera energa), la cual produce humedad, y la nica
diferencia por la cual nuestro coeficiente adiabtico no coincide con el reportado
bibliogrficamente es debido a que el que se reporta bibliogrficamente es de aire seco y el que
Altura (h) Altura (h1) Coeficiente adiabtico ( )
19.8cm 5 cm 1.33
22.7 cm 6.2 cm 1.37
34cm 9.1 cm 1.36
19.5 cm 7 cm 1.56
14.9 cm 3.9 cm 1.35
Promedio 1.394
4
nosotros reportamos es de aire con cierta humedad, por lo comentado antes. Lo cual indica que el
aparato de Clement-Desormes es adecuado.
CONCLUSIN
Durante la prctica se pudo concluir que un proceso adiabtico es aquel en el que el sistema no
intercambia calor con el entorno mientras que en el extremo opuesto, en el que tiene lugar la
mxima transferencia de calor, causando que la temperatura permanezca constante, se denomina
proceso isotrmico. Se pudo obtener de una forma indirecta las capacidades calorficas a presin y
volumen constante del aire utilizando un dispositivo en el cual a travs del cociente de las
diferencias de presiones se obtuvo el coeficiente adiabtico. (es decir la medida de sus alturas) En
esta prctica no se puede afirmar que hubo errores, debido a que el coeficiente adiabtico del aire
tomado bibliogrficamente es de aire seco, mientras que el calculado prcticamente es de aire
que posee cierta humedad, debido a la ubicacin de nuestro pas. Por lo cual podemos decir que
los resultados son bastante aceptables.
CUESTIONARIO
1. Dibuje un esquema simplificado del aparato utilizado sealando todas sus partes
componentes.
Manmetro
Recipiente con gas
(aire)
Perilla
Vlvula de
alivio
APARATO DE CLEMENT-DESORMES
5
2. Fsicamente cmo determina que el sistema haya alcanzado el equilibrio con los
alrededores?
Cuando la presin del manmetro alcanza un valor diferente a la presin inicial
3. qu tipo de proceso ocurre al abrir la vlvula de alivio?
Abriendo rpidamente la vlvula esfrica, se produce una expansin adiabtica, el aire interior se
expande hasta que su presin se iguala a la atmosfrica.
4. Explique por qu aumenta la presin cuando al cerrar la vlvula de alivio deja usted que el
sistema obtenga el equilibrio.
Al bombear aire hacia el interior del recipiente, y cerrar la vlvula para que el sistema alcance el
equilibrio se genera un aumento de la presin al no variar el volumen del lquido contenido en
este. Mientras que al abrir la vlvula, el aire comienza a experimentar un cambio adiabtico,
disminuyendo rpidamente su presin, hasta alcanzar la presin atmosfrica.
5. Cmo relaciona las lecturas obtenidas en el manmetro con la presin real del sistema?
Al bombear aire hacia el interior del recipiente se provoca que aumente la presin dentro del
manmetro (en comparacin con la presin real del sistema), al no variar su volumen de agua, lo
cual se ve reflejado en los incrementos de las lecturas correspondientes a la altura (h).
Mientras que al abrir rpidamente la vlvula de alivio y cerrarla inmediatamente, el aire
comienza a experimentar una expansin adiabtica, ya que la presin del manmetro disminuye
rpidamente hasta alcanzar su equilibrio (presin real del sistema), como se ve reflejado en las
lecturas de la altura (h
1
).
6. En base a sus datos experimentales calcule las capacidades calorficas a presin y volumen
constantes y compare sus resultados con los informados en la bibliografa.
Altura (h)
Altura (h
1
)
C
p
del aire
C
v
del aire
Lectura 1 19.8 5 1.33 0.270 0.3386
Lectura 2 22.7 6.2 1.37 0.184 0.252
Lectura 3 34 9.1 1.36 0.189 0.258
Lectura 4 9.1 7 1.56 0.122 0.190
Lectura 5 14.9 3.9 1.35 0.235 0.303
Comparacin con los datos de la bibliografa
C
p
del aire
C
v
del aire
del aire
0.24 0.1715 1.4
6
CLCULOS
Lectura 1
C
p
/ C
v
= 1.33 C
p
=1.33 C
v
y como C
p
= C
v
+ R.
Igualando ambas expresiones resulta que 1.33 C
v
= C
v
+ R
C
v
= R / 1.33 1 =
6
Como la masa molecular del aire es de 28.98
, entonces 28.98
(
898
Resulta que
=207.03933
207.03933
(
0.207039
. Por lo tanto
C
p
= 7
+ 68
86
Lectura 2
C
p
/ C
v
= 1.37 C
p
=1 .37 C
v
y como C
p
= C
v
+ R.
Igualando ambas expresiones resulta que 1.37 C
v
= C
v
+ R
C
v
= R / 1.37 1 =
5.35
Como la masa molecular del aire es de 28.98
, entonces 28.98
(
898
Resulta que
=184.656706
184.656706
(
.18465
. Por lo tanto
= In P
1
- In P
2
/ In P
1
- In
P
3
= h / h - h
1
C
p
= C
v
+ R
C
p
/ C
v
= h / h - h
1
C
v
= 7
C
p
= 86
C
v
=0 18465
C
p
=0.2529
7
C
p
= 18465
+ 68
59
Lectura 3
C
p
/ C
v
= 1.36 C
p
= .36 C
v
y como C
p
= C
v
+ R.
Igualando ambas expresiones resulta que 1.36 C
v
= C
v
+ R
C
v
= R / 1.36 1 =
55
Como la masa molecular del aire es de 28.98
, entonces 28.98
(
898
Resulta que
=189.78
189.78
(
0.189
. Por lo tanto
C
p
= 189
+ 68
58
Lectura 4
C
p
/ C
v
= 1.56 C
p
= .56 C
v
y como C
p
= C
v
+ R.
Igualando ambas expresiones resulta que 1.56 C
v
= C
v
+ R
C
v
= R / 1.56 1 =
3.5357
Como la masa molecular del aire es de 28.98
, entonces 28.98
(
898
Resulta que
= 122.005
122.005
. Por lo tanto
C
p
= 1
+ 68
19
Lectura 5
C
p
/ C
v
= 1.29 C
p
= .29 C
v
y como C
p
= C
v
+ R.
Igualando ambas expresiones resulta que 1.29 C
v
= C
v
+ R
C
v
= 0 189
C
p
=0.258
C
v
= 1
C
p
=0.1903
8
C
v
= R / 1.29 1 =
6875
Como la masa molecular del aire es de 28.98
, entonces 28.98
(
898
Resulta que
= 5596
235.596
(
55
. Por lo tanto
C
p
= 55
+ 68
7. Explique las diferencias encontradas en el inciso anterior cmo sugiere que se podran
evitar?
Las diferencias entre los resultados y los datos bibliogrficos son muy marcadas lo que da como
resultado un error porcentual medio aproximado de 50%. Las cuales podran ser minimizadas,
con las siguientes condiciones: aplicando correctamente la tcnica de trabajo, empleando
instrumentos de mayor precisin, sellando perfectamente el sistema, debido a que posee ciertas
fugas de aire y hacerlo con aire seco, entre otras ms condiciones.
8. Con los resultados experimentales obtenidos calcule el valor de () para cada uno de los
gases utilizados. Comprelos con los informados en la bibliografa.
Solo se utiliz aire.
calculado
bibliogrfico
Lectura 1 1.33
1.4
Lectura 2 1.37
Lectura 3 1.36
Lectura 4 1.56
Lectura 5 1.29
9. Seale las diferencias entre los siguientes procesos: adiabtico, isotrmico e isocorico.
ADIABTICO ISOTRMICO ISOCORICO
C
v
= 0.2355
C
p
=0.3038
9
Un proceso adiabtico es
aquel que se lleva a cabo sin
intercambio de calor entre el
sistema y los alrededores.
Este tipo de proceso, se
puede efectuar de dos
maneras:
aislando el sistema mediante
paredes adiabticas (que no
permiten el intercambio de
calor).
efectuando el proceso de
manera muy rpida, de tal
manera que el sistema no
tenga tiempo para
intercambiar calor con los
alrededores.
T
1
= T
2
, dado que el cilindro
se encuentra dentro de un
termostato, la temperatura
final es igual a la inicial.
El trabajo realizado por el
gas al expandirse se
aproxima al rea bajo la
isoterma.
En un proceso isotrmico, el
trabajo de expansin de un
gas es mximo y es igual al
rea bajo la isoterma.
el volumen del gas
permanecer constante
la energa interna del
gas aumentar,
reflejndose en un
incremento
concomitante de la
temperatura.
la presin del gas se
incrementar.
USOS Y APLICACIONES
En las industrias la capacidad calorfica de las sustancias juega un papel vital para el balance de la
energa, Simplemente si se necesita cocer un alimento, sabiendo la capacidad calorfica se sabe
cunta energa y cunto tiempo requiere para cocinarse.
Ejemplos estaran en la industria panificadora, muchos dulces se hacen en base a caramelo
derretido. Y hasta en los helados pues debes reducir la temperatura de la mezcla.
Tambin estn las salsas embotelladas muchas de ellas se cocinan. En la pasteurizacin de la
leche, jugos o u otros productos, pues esta consiste en elevar rpidamente su temperatura y
despus enfriarla rpidamente con el fin de inhibir la propagacin bacteriana.
De la misma manera se aplica en otras industrias como la de pinturas donde Se sabe que unos
lquidos se calientan con ms facilidad que otros, es decir, requieren menos cantidad de calor para
elevar la temperatura en la misma cantidad de grados. De la misma manera, a mayor cantidad de
lquido ms tardan en calentarse, o sea, requieren ms cantidad de calor para elevar su
temperatura.
Dos lquidos pueden en un momento dado tener la misma temperatura y sin embargo haber
recibido cantidades diferentes de calor, ya sea porque absorben calor en diferentes proporciones
por su naturaleza molecular o porque hay diferentes cantidades del mismo lquido. La cantidad de
calor que absorbe un lquido es directamente proporcional al tiempo en que permanece en
contacto con la fuente de calor o con el cuerpo ms caliente.
Otras aaplicaciones industriales de la relacin entre las capacidades calorficas de un gas y sus procesos politrpicos
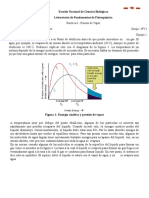
son una planta Simple de Vapor. La figura muestra un diagrama esquemtico de una planta simple
de vapor. El vapor sobrecalentado a alta presin sale de la caldera, que es un elemento del
generador de vapor y entra a la turbina. El vapor se expande en la turbina y mediante esto efecta
un trabajo, lo cual hace que la turbina mueva un generador elctrico. El vapor a baja presin sale
de la turbina y entra al condensador, en donde el calor es transmitido del vapor (haciendo que se
10
condense) al agua de enfriamiento. Debido a que se requieren cantidades muy grandes de agua,
las plantas de fuerza estn situadas cerca de los ros o los lagos. Cuando el agua disponible es
limitada, podr utilizarse una torre de enfriamiento. En la torres de enfriamiento, parte del agua
se evapora, de tal modo que baja la temperatura del agua remanente. La presin del condensado,
al salir del condensador, se aumenta por medio de una bomba que lo hace fluir dentro del
generador de vapor.
En muchos generadores de vapor se utiliza un economizador. El economizador es simplemente un
cambiador de calor en el cual el calor es transmitido de los productos de combustin al
condensado, aumentando la temperatura de ste, pero sin que se efecta ninguna evaporacin.
En otras secciones del generador de vapor se transmite el calor de los productos de combustin al
agua, causando su evaporacin. La temperatura a la cual ocurre la evaporacin se llama
temperatura de saturacin. Entonces el vapor fluye a travs de otro cambiador de calor llamado
sobre calentador, donde la temperatura del vapor sube muy arriba de la temperatura de
saturacin.
Industria del plstico
Produccin de plstico
Dispositivos de mando para el transporte y la distribucin de material para fluido,
accionamiento de vlvulas y cierre de silos.
Fabricacin de piezas de plstico
Ajuste de los rodillos de la calandra, accionamiento de las cuchillas, dispositivos de cierre para
embuticin profunda, dispositivos de soldadura y prensado, control de avance de cintas,
11
dispositivos de conformacin, encolar, accionamiento de dispositivos de seguridad tales como
ventanas y puertas en mquinas e instalaciones, moldeadoras, dispositivos de corte a medida.
BIBLIOGRAFA
CASTELLAN, W. Gilbert.Fisicoqumica. Segunda edicin. Editorial PEARSON. Mxico, D.F.,
1987P.p. 80, 118, 119, 129, 133
http://www.slideshare.net/gobad/experimento-de-clement-y-desormes
http://webserver.dmt.upm.es/~isidoro/lab1/Practicas/Piezometria.pdf
http://www.quiminet.com/articulos/determinacion-de-la-capacidad-calorifica-en-
pinturas-y-recubrimientos-21676.htm
http://www.gestiopolis.com/recursos6/Docs/Ger/aplinreca.htm
You might also like
- Practica 6 - Capacidades CalorificasDocument11 pagesPractica 6 - Capacidades CalorificasYoali Asiain LeconaNo ratings yet
- Practica Capacidad Calorifica de Los GasesDocument9 pagesPractica Capacidad Calorifica de Los GasesAngel Ortega GasparNo ratings yet
- Capacidad Calorífica: Análisis de Procesos Isotérmicos y AdiabáticosDocument6 pagesCapacidad Calorífica: Análisis de Procesos Isotérmicos y AdiabáticosRaúl FonsecaNo ratings yet
- Medición de voltajes con voltímetro y verificación de la ley de KirchhoffDocument6 pagesMedición de voltajes con voltímetro y verificación de la ley de KirchhoffBlackPork54No ratings yet
- Practica 3 Pendulo SimpleDocument5 pagesPractica 3 Pendulo SimpleLuisDelgadoFuentesNo ratings yet
- Adsorción de GibbsDocument7 pagesAdsorción de GibbsvaneNo ratings yet
- Practica 9 Adsorción IiDocument11 pagesPractica 9 Adsorción IiedwinNo ratings yet
- Práctica 5 TermoquímicaDocument8 pagesPráctica 5 TermoquímicaYetzein Mariana MonteroNo ratings yet
- PRACTICA 7 DETERMINACION DE E° Y No DE ELECTRONESDocument13 pagesPRACTICA 7 DETERMINACION DE E° Y No DE ELECTRONESEdwin CastañedaNo ratings yet
- P3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFDocument22 pagesP3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFHelen100% (1)
- Practica 8. - Presion de VaporDocument11 pagesPractica 8. - Presion de VaporJohn Víctor33% (3)
- Practica 3 Ley de BoyleDocument2 pagesPractica 3 Ley de BoyleLeonardo ZamudioNo ratings yet
- Practica 4Document8 pagesPractica 4Evelyn Jim 3295No ratings yet
- Balance de Masa en Un Reactor QuímicoDocument8 pagesBalance de Masa en Un Reactor QuímicoKaren Pao Chikita100% (2)
- Practica 9 FQ Adsorción de Gibbs.Document4 pagesPractica 9 FQ Adsorción de Gibbs.Miriam NavaNo ratings yet
- Presion HidrostaticaDocument6 pagesPresion HidrostaticaOctavio S. SolisNo ratings yet
- Practica 8 Adsorcion 1Document3 pagesPractica 8 Adsorcion 1jk0% (3)
- Practica 6 Energia de Las Reacciones QuimicasDocument4 pagesPractica 6 Energia de Las Reacciones QuimicasLuis AngelNo ratings yet
- Practica 6 Capacidades CalorificasDocument5 pagesPractica 6 Capacidades CalorificasDomingo GuerraNo ratings yet
- Número de Electrones Involucrados en La ReacciónDocument5 pagesNúmero de Electrones Involucrados en La ReacciónLalo TolentinoNo ratings yet
- Practica 4 FISICA Plano InclinadoDocument10 pagesPractica 4 FISICA Plano InclinadoguillermoNo ratings yet
- Practica Final RefractometriaDocument11 pagesPractica Final RefractometriaArmando Darien SantiagoNo ratings yet
- Equipo 3 2qv2 Adsorción IIDocument6 pagesEquipo 3 2qv2 Adsorción IIYetzein Mariana Montero100% (1)
- Practica No. 2 Destilacion Por Arrastre de VaporDocument2 pagesPractica No. 2 Destilacion Por Arrastre de VaporMarifer RosasNo ratings yet
- Calorimetría Práctica 7Document5 pagesCalorimetría Práctica 7Rosalba HernándezNo ratings yet
- Practica 8 Propiedades ColigativasDocument5 pagesPractica 8 Propiedades ColigativasBlackPork54No ratings yet
- Síntesis A Microescala de Ácido FumaricoDocument2 pagesSíntesis A Microescala de Ácido FumaricoKarlaNo ratings yet
- Practica 3 FisicoquímicaDocument10 pagesPractica 3 FisicoquímicaRocha Valdovinos Aurelio NicolásNo ratings yet
- FQ - 2QV1 - Eq. 1 - P. 9 Adsorción IDocument10 pagesFQ - 2QV1 - Eq. 1 - P. 9 Adsorción IJesus Alberto Martinez GutierrezNo ratings yet
- Determinación del punto isoeléctrico de la insulina mediante análisis de solubilidad a diferentes pHDocument8 pagesDeterminación del punto isoeléctrico de la insulina mediante análisis de solubilidad a diferentes pHNathan Ulises Reyes JimenezNo ratings yet
- Cromatografia Por AdsorcionDocument3 pagesCromatografia Por AdsorcionLi ClementeNo ratings yet
- Práctica# 5 Presión HidrostáticaDocument10 pagesPráctica# 5 Presión HidrostáticaChio Ambriz67% (3)
- Tensión superficialDocument5 pagesTensión superficialAlex Rey33% (3)
- Práctica 9Document9 pagesPráctica 9Rosalba HernándezNo ratings yet
- Practica 7 - Determinación de Calor de CombustiónDocument11 pagesPractica 7 - Determinación de Calor de CombustiónYoali Asiain LeconaNo ratings yet
- Practica 8 Termo¡Document13 pagesPractica 8 Termo¡Venus Almazan RojasNo ratings yet
- Práctica 2 Titulación ConductimétricaDocument5 pagesPráctica 2 Titulación ConductimétricaLuisolmeca FeNo ratings yet
- Practica Titulacion Conductimetrica y Mediciones ConductividadDocument7 pagesPractica Titulacion Conductimetrica y Mediciones ConductividadTann MoralesNo ratings yet
- Síntesis de ciclohexanoximaDocument3 pagesSíntesis de ciclohexanoximaFernanda DomínguezNo ratings yet
- Caída AmortiguadaDocument10 pagesCaída AmortiguadaDante PalaciosNo ratings yet
- Práctica 5 FísicaDocument7 pagesPráctica 5 FísicaDiegoSeguraNo ratings yet
- Practica 11 Sintesis de DibenzalacetonaDocument3 pagesPractica 11 Sintesis de DibenzalacetonaPio Avila0% (1)
- Caída AmortiguadaDocument8 pagesCaída AmortiguadaAdriana Perez100% (2)
- Practica 2 Fisico Quimicos Influencia de Temperatura en La Velocidad de ReaccionDocument5 pagesPractica 2 Fisico Quimicos Influencia de Temperatura en La Velocidad de ReaccionDiego Roesch0% (1)
- Practica7 Cinetica de Las Reacciones QuimicasDocument6 pagesPractica7 Cinetica de Las Reacciones QuimicasLuis AngelNo ratings yet
- Práctica 3. Mediciones de PH y Capacidad ReguladoraDocument12 pagesPráctica 3. Mediciones de PH y Capacidad ReguladoralizNo ratings yet
- Bitacora de TrabajoP3Document3 pagesBitacora de TrabajoP3Alexis GudiñoNo ratings yet
- Practica 1 Fisicoquimica Ley de BoyleDocument7 pagesPractica 1 Fisicoquimica Ley de BoyleCarlitos HernandezNo ratings yet
- Ley de Boyle (Practica 2)Document8 pagesLey de Boyle (Practica 2)Emmanuel Dorantes MolinaNo ratings yet
- Cinética de Las Reacciones QuímicasDocument12 pagesCinética de Las Reacciones QuímicasMatraz23100% (1)
- Potencial NormalDocument8 pagesPotencial Normaladriana lizeth arzate guillenNo ratings yet
- Práctica 2 MezcladoDocument11 pagesPráctica 2 MezcladoIlseNo ratings yet
- Laboratorio de Físicoquimica - Practica 10Document11 pagesLaboratorio de Físicoquimica - Practica 10Cesar SuarezNo ratings yet
- Sintesis Del CiclohexanoximaDocument3 pagesSintesis Del CiclohexanoximaViriato17No ratings yet
- Practica 4 Sintesis de Acido FumaricoDocument4 pagesPractica 4 Sintesis de Acido FumaricoFredo ReyesNo ratings yet
- Practica No.3 Blance de Masa en Un Proceso de Mezclado Sin Reaccion PDFDocument13 pagesPractica No.3 Blance de Masa en Un Proceso de Mezclado Sin Reaccion PDFOz HdzNo ratings yet
- Reactor Quimico Practica No. 3Document6 pagesReactor Quimico Practica No. 3Jordan Josue Torres100% (1)
- PRACTICA 3 OhmetroDocument14 pagesPRACTICA 3 Ohmetroandypa100% (1)
- Síntesis A Microescala de Acido FumáricoDocument2 pagesSíntesis A Microescala de Acido FumáricoMar Dz H0% (1)
- Practica 1 Quimica IndustrialDocument20 pagesPractica 1 Quimica IndustrialAreely Alvaarez100% (2)
- Practica Final RefractometriaDocument11 pagesPractica Final RefractometriaArmando Darien SantiagoNo ratings yet
- Tema Vi Combustic3b3n1Document13 pagesTema Vi Combustic3b3n1nose_nada222No ratings yet
- Guia PAA CollegeboardDocument83 pagesGuia PAA Collegeboardoctabond_007100% (2)
- Guia PAA CollegeboardDocument83 pagesGuia PAA Collegeboardoctabond_007100% (2)
- AcerosDocument7 pagesAcerosArmando Darien SantiagoNo ratings yet
- LP Tracción en Diferentes MaterialesDocument6 pagesLP Tracción en Diferentes MaterialesLupita MéndezNo ratings yet
- Conceptos de FisicaDocument2 pagesConceptos de FisicaElian0% (1)
- Práctica 7. Circuitos EléctricosDocument10 pagesPráctica 7. Circuitos EléctricosAndrea GonzálezNo ratings yet
- Labmeii Practicas 2035534Document80 pagesLabmeii Practicas 2035534Diego CorpusNo ratings yet
- Flexión simple viga 40Document22 pagesFlexión simple viga 40Johao Reyes100% (1)
- Cálculo de fuerzas de rodillos para molinos de dos y cuatro rodillos con medias tensiones de fluenciaDocument4 pagesCálculo de fuerzas de rodillos para molinos de dos y cuatro rodillos con medias tensiones de fluenciaDaniel Beleño MolinaNo ratings yet
- Ins Espe 02-ActividadesDocument6 pagesIns Espe 02-ActividadesYerfri GonzalezNo ratings yet
- Acero 9840Document1 pageAcero 9840Saul Fernando Cujaban AceroNo ratings yet
- Practica Protoboard PDFDocument4 pagesPractica Protoboard PDFMayte García ÁlvarezNo ratings yet
- Informe RMT FinalDocument23 pagesInforme RMT Finalstefano mujica winchonlong100% (1)
- Termodinámica y gases idealesDocument15 pagesTermodinámica y gases idealeskewis jose santanaNo ratings yet
- Fuente de Poder Regulable 24 VDCDocument5 pagesFuente de Poder Regulable 24 VDCErick Cuenca EstradaNo ratings yet
- Cálculo de ResortesDocument4 pagesCálculo de ResortesFanny Bettina Lubo LozadaNo ratings yet
- Las Derivadas y Sus AplicacionesDocument66 pagesLas Derivadas y Sus AplicacionesPatricio Alejandro Benavides GuerraNo ratings yet
- Sae 1010Document1 pageSae 1010Cristian HNo ratings yet
- Estimulacion y Fracturas - HalliburtonDocument88 pagesEstimulacion y Fracturas - HalliburtonMaria Ines Lombardo100% (1)
- Ensayo de PozosDocument36 pagesEnsayo de PozosBrandon Parada0% (1)
- Tablas de Terrmocuplas y Pt100Document18 pagesTablas de Terrmocuplas y Pt100glizamabNo ratings yet
- Libro Optimizacion de Sistemas de Produccion (ESPOIL Nov. 2014)Document492 pagesLibro Optimizacion de Sistemas de Produccion (ESPOIL Nov. 2014)Maria Fabiola Pernalete100% (3)
- MÉTODO DOBLE INTEGRACIÓN VIGADocument4 pagesMÉTODO DOBLE INTEGRACIÓN VIGAAlvaritoDuranArismendi100% (1)
- Evolución estructuras concreto armado PerúDocument17 pagesEvolución estructuras concreto armado PerúOscar PintadoNo ratings yet
- Dilatacion de Solidos y Liquidos PDFDocument32 pagesDilatacion de Solidos y Liquidos PDFJennifer Smith100% (4)
- 4 Uniones SoldadasDocument21 pages4 Uniones Soldadaszelmyc segurondoNo ratings yet
- Curso de Mantenimiento Del Horno MicroondasDocument27 pagesCurso de Mantenimiento Del Horno MicroondasAlbert PzNo ratings yet
- Total Materia - Vista Comparativa T35 MN 14 Vs SAE 1536 Vs ASTM299 Vs ASTM 538 1536Document2 pagesTotal Materia - Vista Comparativa T35 MN 14 Vs SAE 1536 Vs ASTM299 Vs ASTM 538 1536Lucas MaldonadoNo ratings yet
- Electrotecnia QuimicosDocument4 pagesElectrotecnia QuimicosGerman MottoNo ratings yet
- Entropia Gas RealDocument7 pagesEntropia Gas RealAldry SolizNo ratings yet
- Memoria de Calculo Grua PorticoDocument16 pagesMemoria de Calculo Grua PorticoCesar ColanNo ratings yet
- Capítulo 2 - El Sistema FotovoltaicoDocument20 pagesCapítulo 2 - El Sistema FotovoltaicoAlfredo Enrique SosaNo ratings yet