Professional Documents
Culture Documents
Consigna 4
Uploaded by
api-2585067220 ratings0% found this document useful (0 votes)
38 views4 pagesOriginal Title
consigna 4
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
38 views4 pagesConsigna 4
Uploaded by
api-258506722Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 4
CONSIGNAS DE APRENDIZAJES Y EVALUACION
Haga un listado de las caractersticas utilizadas para determinar la velocidad de la reaccin
Caractersticas
1. La velocidad de reaccin se define como la cantidad de sustancia que se transforma en una determinada reaccin por
unidad de volumen y tiempo.
2. La velocidad de reaccin es siempre positiva.
3. Una de las caractersticas de las reacciones qumicas ms espectaculares es que ocurren con extrema rapidez.
4. La velocidad de reaccin no es constante.
5. Al principio, cuando la concentracin de reactivos es mayor, tambin es mayor la probabilidad de que se den choques
entre las molculas de reactivo, y la velocidad es mayor. a medida que la reaccin avanza, al ir disminuyendo la concentracin
de los reactivos, disminuye la probabilidad de choques y con ella la velocidad de la reaccin.La medida de la velocidad de
reaccin implica la medida de la concentracin de uno de los reactivos o productos a lo largo del tiempo, esto es, para medir la
velocidad de una reaccin necesitamos medir, bien la cantidad de reactivo que desaparece por unidad de tiempo, bien la
cantidad de producto que aparece por unidad de tiempo.La velocidad de reaccin se mide en unidades de
concentracin/tiempo, esto es, en moles/s.
6. La velocidad media de reaccin se calcula como la cantidad de reactivo consumido (o de producto formado), expresada
en moles/litro, en un determinado tiempo:
7. La velocidad de las reacciones depende de las diferentes naturalezas de las sustancias que intervienen.
8. La velocidad de reaccin depende tambin de las caractersticas qumicas de las diferentes sustancias que participan del
proceso de la reaccin, as como tambin de su estado fsico, concentracin de reactivos, temperatura e incluso de la presencia
o no de catalizadores.
9. el estado fsico de los reactivos condicionar la velocidad de las reacciones. Bastantes reacciones tienen lugar en estado
gaseoso preferentemente, o tambin en disolucin, pues as las molculas poseen mayor libertad de movimiento y se ponen de
manera ms sencilla en contacto con otras. Por lo general, las reacciones qumicas que tienen lugar en disolucin donde
participan iones,
10. En las reacciones heterogneas, la velocidad de reaccin es dependiente de la superficie de contacto entre las dos fases,
siendo mayor cuando mayor sea el estado de divisin. De esta manera, un fragmento compacto de madera o de otra sustancia,
como el carbn, arder de manera ms lenta que si se encontrara pulverizado, as el contacto del oxgeno que se encuentra en
el aire, con los combustibles ser mucho mayor, pudiendo incluso el carbn hecho polvo, llegar a arder con una velocidad
altamente explosiva.
11. La velocidad de reaccin qumica, puede tambin depender de la concentracin de los reactivos. Se puede comprobar
cientficamente que la velocidad crece cuando lo hacen las concentraciones de las especies reaccionantes.
12. Por lo general, en la mayora de las reacciones, la velocidad es dependiente de la concentracin que haya de los
reactivos, sin embargo, existen casos en los que la velocidad de reaccin depende de las concentraciones de cada especie que
no aparecen en la ecuacin estequiomtrica de la reaccin problema. Eso es debido, a que el mecanismo por el cual tienen lugar
dichas reacciones, es decir, la forma como los reactivos se transforman en productos, tiene lugar de una manera compleja. Por
lo cual, la comprobacin cientfica de la velocidad de reaccin proporcionar una informacin de utilidad para poder conocer el
mecanismo de la reaccin.
13. La temperatura suele afectar de una manera bastante notable a la velocidad de las reacciones qumicas. Por lo general,
un aumento de la temperatura condiciona un aumento de la velocidad de la reaccin. Cuando las temperaturas estn prximas
a la temperatura que hay en el ambiente, un aumento de 10C multiplicara la velocidad de la reaccin por dos. En algunas
reacciones de tipo biolgicas, este factor podra tener una diferencia mucho mayor.
14. La velocidad de las reacciones qumicas, se puede ver modificada cuando existe la presencia de catalizadores. Un
catalizador, es una sustancia que aumenta la velocidad de una reaccin qumica, participando en la misma reaccin pero sin
consumirse, por lo tanto, la cantidad de catalizadores que hay, es mnima, tanto al principio, como al final del proceso. Los
catalizadores no afectan al estado del equilibrio de un sistema qumica, pues nicamente aumenta la velocidad con la que se
llega al estado de equilibrio. Por otro lado, los catalizadores son especficos de cada reaccin, es decir, que un mismo
catalizador no puede causar el mismo efecto para todo tipo de reacciones.
15. Se define la velocidad de una reaccin qumica como la cantidad de sustancia formada (si tomamos como referencia un
producto) o transformada (si tomamos como referencia un reactivo) por unidad de tiempo.
16. El aumento de la concentracin de los reactivos hace ms probable el choque entre dos molculas de los reactivos, con
lo que aumenta la probabilidad de que entre estos reactivos se de la reaccin. En el caso de reacciones en estado gaseoso la
concentracin de los reactivos se logra aumentando la presin, con lo que disminuye el volume.
17. Si la reaccin se lleva a cabo en disolucin lo que se hace es variar la relacin entre el soluto y el disolvente.
En la simulacin que tienes a la derecha puedes variar la concentracin de una o de ambas especies reaccionantes y observar
cmo influye este hecho en la velocidad de la reaccin qumica.
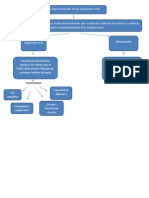
Seale por medio de un cuadro sinptico las caractersticas que lo diferencian
A) dada una reaccin qumica 2A + B > C con una ecuacin de tasar = k [A]
2
[B]
1
el orden de reaccin con respecto a A sera 2 y con respecto a B sera 1, el orden
de reaccin total sera 2 + 1 = 3. No es necesario que el orden de una reaccin
sea un nmero entero; cero y valores fraccionarios de orden son posibles, pero
ellos tienden a ser enteros. Ordenes de reaccin pueden ser determinados
solamente por experimentos. Su conocimiento conduce a conclusiones sobre el
mecanismo de reaccin.
B) El orden de reaccin no est necesariamente relacionado a la estequiometra de la
reaccin, a menos que la reaccin sea elemental. Reacciones complejas pueden
tener o no rdenes de reaccin iguales a sus coeficientes estequiomtricos.
C) Una determinacin importante en el estudio de la cintica de una reaccin qumica
es la del orden de reaccin.
D) Conviene recordar, en los casos ms simples, lo que se entiende por orden de
reaccin. Siendo Co la concentracin inicial del reactivo y C la concentracin del
reactivo pasado el tiempo t de reaccin, si dC/dt obedeciese a la ecuacin (1), n
ser el orden de reaccin.
E) En algunas reacciones, las velocidades son proporcionales a las concentraciones de los
Orden de Reaccin CARACTERISTICAS
reactivos elevadas a una potencia. Slo en esos casos, conviene hablar de orden de reaccin.
Si la velocidad es directamente proporcional a una sola concentracin, se tendr que v = k c y
se dice que la reaccin es de primer orden. Un ejemplo de este tipo de reaccin es la
descomposicin del etano en fase gaseosa C2H6 =C2H4 + H2
F) El orden de reaccin est definido como la suma de los exponentes de las
concentraciones en la ley de la rapidez de la reaccin. Este es tambin
llamado orden total de reaccin, pues el orden depende del reactivo que se
analice.
g) El orden de la reacciones se determina experimentalmente.
C
O
N
C
E
P
T
ES LA POTENCIA
(EXPONENCIAL) A LA
CUAL SU TERMINO
DE CONCENTRACIN
EN LA ECUACION DE
TASA ES
ELEVADO.
You might also like
- Respuestas Ejercicios 12 Febrero Trim-15I PDFDocument3 pagesRespuestas Ejercicios 12 Febrero Trim-15I PDFEstéfana AlvaradoNo ratings yet
- Problemas de ReactoresDocument10 pagesProblemas de ReactoresAlberto ArteagaNo ratings yet
- Modelamiento y casos especiales de la cinética química heterogéneaFrom EverandModelamiento y casos especiales de la cinética química heterogéneaRating: 3 out of 5 stars3/5 (1)
- Ejercicios Sesion 4.1 PDFDocument3 pagesEjercicios Sesion 4.1 PDFCarlos Israel Esparza AndradeNo ratings yet
- Colección de Ejercicios ResueltosDocument20 pagesColección de Ejercicios ResueltosSara RsNo ratings yet
- Reactores IIIIIIIDocument15 pagesReactores IIIIIIIarnoldNo ratings yet
- Previo2 Equipo8 QoiiDocument6 pagesPrevio2 Equipo8 QoiiValeria ZarzaNo ratings yet
- UC 2-Cinética QuímicaDocument41 pagesUC 2-Cinética QuímicaAli FajardoNo ratings yet
- Articulo Científico Cinética QuímicaDocument6 pagesArticulo Científico Cinética QuímicaALONDRA VIGUERAS GALVEZNo ratings yet
- Cinetica ExpoDocument15 pagesCinetica ExpoKPNo ratings yet
- Guía de La Práctica 5. Cinética QuímicaDocument10 pagesGuía de La Práctica 5. Cinética QuímicaRosmery GonzalesNo ratings yet
- Cinética de Las Reacciones QuimicasDocument33 pagesCinética de Las Reacciones QuimicasElizabeth ChirinosNo ratings yet
- Boletin 3 Velocidad de ReacciónDocument5 pagesBoletin 3 Velocidad de ReacciónDana RamirezNo ratings yet
- Cinética química: factores que influyen en la velocidad de reacciónDocument18 pagesCinética química: factores que influyen en la velocidad de reacciónSergio Luis RodriguezNo ratings yet
- Guía de Cinetica QuímicaDocument11 pagesGuía de Cinetica QuímicaCamila MendozaNo ratings yet
- Cinética de La ReduccionDocument7 pagesCinética de La ReduccionSara Michelle OlmosNo ratings yet
- Posible Teria Cinetica U2Document3 pagesPosible Teria Cinetica U2luis antonio pascual lozanoNo ratings yet
- Guia de Laboratorio AlumnosDocument11 pagesGuia de Laboratorio AlumnosSamira Belen Ruíz DelgadilloNo ratings yet
- Teorias de Velocidad de ReacciónDocument25 pagesTeorias de Velocidad de ReacciónDavid Axel 666 Contreras PérezNo ratings yet
- Cinética QuímicaDocument8 pagesCinética QuímicaLeslie ingrid VenegasNo ratings yet
- Informe Química UnoDocument7 pagesInforme Química UnodanielNo ratings yet
- Cinética y Orden de Las Reacciones de DegradaciónDocument26 pagesCinética y Orden de Las Reacciones de DegradaciónMontse Acosta100% (1)
- Capitulo 7. Clase 9 Cinética y Equilibrio QunímicoDocument55 pagesCapitulo 7. Clase 9 Cinética y Equilibrio QunímicoGustavoLuisBianchiNo ratings yet
- Cinetica QuimicaDocument28 pagesCinetica QuimicaRaldo JuarezNo ratings yet
- Laboratorio Nº8 CINETICADocument22 pagesLaboratorio Nº8 CINETICAMarcos Jhoel Condori SotoNo ratings yet
- Descomposicion Catalitica Del Peroxido de Hidrogeno 1Document7 pagesDescomposicion Catalitica Del Peroxido de Hidrogeno 1Luiz Felipe Correa CardenasNo ratings yet
- Laboratorio N° 8Document31 pagesLaboratorio N° 8Lizeth Mamani GutierrezNo ratings yet
- Grupo 5Document10 pagesGrupo 5Pedro SiriasNo ratings yet
- Cinetica QuímicaDocument28 pagesCinetica QuímicaJohanna MarinNo ratings yet
- CINÉTICA QUÍMICaDocument5 pagesCINÉTICA QUÍMICaconstanza.salas.1No ratings yet
- Materia Cinética Química - FQDocument24 pagesMateria Cinética Química - FQJhamie AbarcaNo ratings yet
- Equilibrio Químico: Constante de Equilibrio KcDocument18 pagesEquilibrio Químico: Constante de Equilibrio KcRamos Aguilar Wilbert100% (1)
- Fisicoquimica Resumenes Seccion ADocument28 pagesFisicoquimica Resumenes Seccion AVanessa LeydiNo ratings yet
- Informe Marco Teorico Cinetica QuimicaDocument4 pagesInforme Marco Teorico Cinetica QuimicaMarisol Nieves Davila CompahuallpaNo ratings yet
- Práctica 1Document6 pagesPráctica 1ingrid teranNo ratings yet
- Prelab 8 USFQ QUIMICADocument3 pagesPrelab 8 USFQ QUIMICAMaria Emilia ChavezNo ratings yet
- 3 Cinetica QuimicaDocument28 pages3 Cinetica QuimicaAlfredo Gonzalez MateoNo ratings yet
- Capítulo 3Document50 pagesCapítulo 3Anthonio Casos MendozaNo ratings yet
- Practica 4 Cinética y Reactorés ESIQIEDocument11 pagesPractica 4 Cinética y Reactorés ESIQIEAngell Glez Salgado100% (1)
- FISICOQUIMICA LL Cinética QuímicaDocument5 pagesFISICOQUIMICA LL Cinética QuímicaRo CLNo ratings yet
- Cinética QuimicaDocument11 pagesCinética Quimicaluis david rosales villarrealNo ratings yet
- 2.2-2.3 Propuesta Gen Datos Cin y Met de Det de Vel de RXNDocument6 pages2.2-2.3 Propuesta Gen Datos Cin y Met de Det de Vel de RXNFercho GarciaNo ratings yet
- Apunte Unidad #3 - Cinética QuímicaDocument16 pagesApunte Unidad #3 - Cinética QuímicaMarcos AgustinNo ratings yet
- Velocidad de Reaccion-Eq2Document22 pagesVelocidad de Reaccion-Eq2KPNo ratings yet
- Cinetica de ReacciónDocument9 pagesCinetica de ReacciónFiorela ApolinarioNo ratings yet
- Antcedentes Practica 2 Orgánica IIDocument4 pagesAntcedentes Practica 2 Orgánica IIEdNo ratings yet
- CatalisisDocument8 pagesCatalisisMarichel Huerta RomeroNo ratings yet
- Guia 5. Cinetica Quimica - Velocidad de Reaccion y Equilibrio QuimicoDocument26 pagesGuia 5. Cinetica Quimica - Velocidad de Reaccion y Equilibrio QuimicoJhonnie GaonaNo ratings yet
- CINETICA QUIMICA. InformeDocument5 pagesCINETICA QUIMICA. InformeFernanda MartinezNo ratings yet
- Teoria 7. Cinetica Quimica-23Document45 pagesTeoria 7. Cinetica Quimica-23Jazminne VillenaNo ratings yet
- Practica 4 Tecnicas CorregidoDocument6 pagesPractica 4 Tecnicas CorregidoJoelNo ratings yet
- Práctico #2 QUUM - 1000 Otoño 2022Document10 pagesPráctico #2 QUUM - 1000 Otoño 2022dafnekarinaaa21No ratings yet
- Cinética QuímicaDocument27 pagesCinética QuímicaNkakak KkakakNo ratings yet
- Teórico 8 Cinética 2023Document31 pagesTeórico 8 Cinética 2023facuchilinchavideNo ratings yet
- Ingeniería de Reacciones Químicas I: - Cinética de Las Reacciones - Velocidad de ReacciónDocument27 pagesIngeniería de Reacciones Químicas I: - Cinética de Las Reacciones - Velocidad de ReacciónJuan Steward Flores AmasifuénNo ratings yet
- Cinética Química y Preparación de SolucionesDocument24 pagesCinética Química y Preparación de SolucionesJohn Alexander Taquio YangaliNo ratings yet
- Cinética químicaDocument25 pagesCinética químicavalita.chandiaNo ratings yet
- Explicación Experimento No. 2. Hidrólisis de Cloruro de Terc-ButiloDocument7 pagesExplicación Experimento No. 2. Hidrólisis de Cloruro de Terc-ButiloPAULINA PEREZ CAMPOSNo ratings yet
- Tema 4-Cinética QuímicaDocument51 pagesTema 4-Cinética Químicasamuelaltamirano870No ratings yet
- Indagación 1. FuerzaDocument5 pagesIndagación 1. FuerzalilianaleijaaNo ratings yet
- Factores que afectan la velocidad de reacción químicaDocument2 pagesFactores que afectan la velocidad de reacción químicaangela bazalduaNo ratings yet
- Tema 51 - MadDocument30 pagesTema 51 - MadIzaskun IGOA LIZARRAGANo ratings yet
- Previo 8 EyCDocument3 pagesPrevio 8 EyCRodolfo Justo CortesNo ratings yet
- Mapa Conceptuall Bioquimica Unidad 1Document1 pageMapa Conceptuall Bioquimica Unidad 1api-259248541No ratings yet
- Mapa de Las ProteinasDocument1 pageMapa de Las Proteinasapi-259248541No ratings yet
- Mapa 5Document1 pageMapa 5api-258506722No ratings yet
- Consigna 1Document7 pagesConsigna 1api-258506722No ratings yet
- Mapa Conceptual Del MetabolismoDocument1 pageMapa Conceptual Del Metabolismoapi-259248541No ratings yet
- Laboratorio n2Document14 pagesLaboratorio n2api-259248541No ratings yet
- Laboratorio n5Document7 pagesLaboratorio n5api-258506722No ratings yet
- Laboratorio n3Document9 pagesLaboratorio n3api-259248541No ratings yet
- Laboratorio n1Document17 pagesLaboratorio n1api-259248541No ratings yet
- Diseño DereactoreshomogeneosDocument84 pagesDiseño DereactoreshomogeneosAnnie SewickNo ratings yet
- 3.a.cinetica y Diseno de ReactoresDocument17 pages3.a.cinetica y Diseno de Reactorespilarsalazarl39gmail.comNo ratings yet
- Informe de Cinética de Una Reacción.Document11 pagesInforme de Cinética de Una Reacción.Emilio Ramirez100% (2)
- Problemas Adicionales Teoria 2017Document2 pagesProblemas Adicionales Teoria 2017Juan AparicioNo ratings yet
- Ejemplos Unit V-IiDocument15 pagesEjemplos Unit V-IiHenry Lambis MirandaNo ratings yet
- ADA3 IngReactoresDocument7 pagesADA3 IngReactoresAndrea CerveraNo ratings yet
- Estudio de La Cinetica de Oxidación Del Ion Ioduro Con Persulfato de AmonioDocument12 pagesEstudio de La Cinetica de Oxidación Del Ion Ioduro Con Persulfato de AmonioLuciana Camila Olivera AguilarNo ratings yet
- Problemas Aplicados A La Ingenieria QuimicaDocument48 pagesProblemas Aplicados A La Ingenieria QuimicaKate Hdez100% (2)
- Equipo 2 - Reporte 2 - CQDocument11 pagesEquipo 2 - Reporte 2 - CQMiros TorresNo ratings yet
- Cinematica QuimicaDocument66 pagesCinematica QuimicaholahuguitoNo ratings yet
- JG y Eg FlotationDocument119 pagesJG y Eg FlotationJaime Omar Godinez RevelesNo ratings yet
- PDF - Termodinámica y Enzimas PDFDocument12 pagesPDF - Termodinámica y Enzimas PDFYesica Apaza MamaniNo ratings yet
- 5-Pruebas de Laboratorio para Fracturamiento Hidráulico ÁcidoDocument13 pages5-Pruebas de Laboratorio para Fracturamiento Hidráulico ÁcidomigueltejedaNo ratings yet
- Sulfato de GermanioDocument14 pagesSulfato de GermanioAnonymous 1UfNueINo ratings yet
- Tarea Semana 9Document11 pagesTarea Semana 9RAMOS OLLACHICA MARYORI JENNIFERNo ratings yet
- Primer Periodo QUÍMICADocument4 pagesPrimer Periodo QUÍMICAdannaNo ratings yet
- Bioquímica InformeDocument8 pagesBioquímica InformecarolinaNo ratings yet
- Guia Seminario Unidad 2Document7 pagesGuia Seminario Unidad 2Daira AlisterNo ratings yet
- Plan Estudios Química IPNDocument34 pagesPlan Estudios Química IPNAlejandro Gonzalez BecerrilNo ratings yet
- Práctica: Simulación de Las Velocidades de ReacciónDocument4 pagesPráctica: Simulación de Las Velocidades de ReacciónMontse ZárateNo ratings yet
- Semana 12Document71 pagesSemana 12ManuelNo ratings yet
- Hidrometalurgia Del CobreDocument35 pagesHidrometalurgia Del CobreLuzBraNo ratings yet
- Post 3 Estudio Cinetico Del TiosulfatoDocument9 pagesPost 3 Estudio Cinetico Del TiosulfatoRosa María Caballero BenitezNo ratings yet
- Unidad 1Document66 pagesUnidad 1Carolina Caballero MedinaNo ratings yet
- Practica Cinética QuímicaDocument10 pagesPractica Cinética QuímicaCM DanyNo ratings yet