Professional Documents
Culture Documents
Práctica 1 - Identificaciónde Cationes A La Flama
Uploaded by
José RiveraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Práctica 1 - Identificaciónde Cationes A La Flama
Uploaded by
José RiveraCopyright:
Available Formats
ndice
Pgina
Objetivo .........................................................................................................1
Introduccin ..................................................................................................1
Fundamento ..................................................................................................2
Material y equipo ..........................................................................................3
Reactivos ........................................................................................................3
Procedimiento ...............................................................................................3
Observaciones: ..............................................................................................4
Reacciones .....................................................................................................9
Conclusiones ................................................................................................ 10
Bibliografa .................................................................................................. 11
1
Prctica 1
Nombre
IDENTIFICACIN DE CATIONES A LA FLAMA
Objetivo
Identificar a travs de la flama cationes que emitan radiacin en la regin visible y
ultravioleta cercano o de cuarzo.
Introduccin
En condiciones normales los tomos se encuentran en el estado fundamental, que es el
ms estable termodinmicamente. Sin embargo, si los calentamos absorben energa y alcanzan
as un estado excitado como se muestra en la Figura 1.1. Este estado posee una energa
determinada, que es caracterstica de cada sustancia. Los tomos que se encuentran en un
estado excitado tienen tendencia a volver al estado fundamental, que es energticamente ms
favorable. Para hacer esto deben perder energa, por ejemplo, en forma de luz. Puesto que los
estados excitados posibles son peculiares para cada elemento y el estado fundamental es
siempre el mismo, la radiacin emitida ser tambin peculiar para cada elemento y por lo tanto
podr ser utilizada para identificarlo. Esta radiacin depender de la diferencia entre los
estados excitados y el fundamental de acuerdo con la ley de Planck:
(1.1)
= Diferencia de energa entre los estados excitado y fundamental.
= Constante de Planck (
-
).
= Frecuencia.
Por lo tanto, el epectro de emiin puede coniderare como la huella dactilar de un
elemento. Este hecho se conoca ya desde antiguo, antes an de entender como ocurra, por lo
que lo qumico han utilizado lo enayo a la llama como un mtodo encillo de
2
identificacin. En la actualidad existen tcnicas de anlisis basadas en este principio, tales
como la espectroscopia de emisin atmica, que nos permiten no slo identificar, sino
cuantificar la presencia de distintos elementos.
Figura 1.1. Representacin grfica de los tomos en estado fundamental hasta un estado
excitado expuestos a la flama.
Fundamento
Cuando un elemento absorbe energa suficiente de una flama o de un arco elctrico,
emite energa radiante. La radiacin emitida puede pertenecer al intervalo de la luz visible,
aunque esto no tiene por qu ocurrir siempre.
Los compuestos slidos se evaporan y se convierten parcialmente en tomos gaseosos.
Por ejemplo:
3
+
NaCl
(s)
NaCl
(g)
Na
(g)
Cl
(g)
Una pequea fraccin de tomos gaseosos son excitados por la energa trmica. Estos
tomos excitados no son estables por largos periodos y regresan al estado basal con emisin de
Luz VISIBLE o UV.
Na
(g)
Na
(g)
h
Na
(g)
*
+
El poder radiante de la luz depende del nmero de tomos excitados en la flama. Como
la luz se propaga en todas las direcciones se hace una consideracin geomtrica. Solo
determinada fraccin de la luz emitida podr enfocarse sobre el detector.
Na
(g)
e Na
(g)
+
+
-
Material y equipo
9 vidrios de reloj
2 vasos de precipitados de 10 ml.
Mechero de Bunsen
Asa de platino o punta de grafito
Vidrio de Cobalto
Reactivos
HCl diluido
Sales un xidos de: Na, K, Ba, Li,
Cu, Co, y Ca.
Procedimiento
1. Conectar el mechero de Bunsen a la corriente de gas y prenderlo.
2. Sumergir verticalmente el asa de platino o punta de grafito en un vaso con HCl diluido
(1:1).
3. Tomar con el asa o punta de grafito un poco de la sal de cada catin a analizar.
4. Introducir el asa de platino o punta de grafito a la flama azul del mechero.
(1.2)
(1.3)
(1.4)
4
5. En caso del potasio hacer una prueba ms observando la coloracin de la flama a
travs del vidrio de cobalto.
6. Localizar la coloracin de cada ensayo en un crculo cromtico para el reporte de
resultados en el cuadro.
Nota: En caso de derramar sal sobre el mechero, apagarlo y limpiarlo para evitar
interferencias en posteriores ensayos.
Observaciones:
Previamente antes de comenzar con la prctica, procedimos a etiquetar cada uno
lpices (a los cuales previamente se les sac un punta de aproximadamente 6 cm) con la
frmula qumica de cada una de las sales empleadas en la prctica, cada una de las cuales se
coloc dentro de una caja de Petri respectivamente (Figura 1.2). Tambin se dispuso HCl
(incoloro) 0.1 M en 2 vasos de precipitados de 10 ml cada uno, y un vidrio de cobalto l cual
se us en la prueba de potasio (K).
Figura 1.2. Cajas de Petri con las muestras de las sales a analizar, y el vidrio de cobalto.
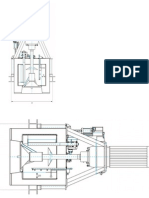
Al momento de iniciar nuestra prctica, se procedi a conectar el mechero (Figura 1.4),
el cual debi estar limpio para para que la flama pudiera salir correctamente; posteriormente se
5
procedi a encender el mechero y a regular la entrada de oxgeno al mechero, para obtener una
flama de proporciones deseadas. Asimismo se prepar una carpeta de color negro, la cual se
coloc como fondo en cada una de las pruebas realizadas con el fin de observar mejor el color
de la flama producida por cada respectivo catin.
Figura 1.3. Esquema del procedimiento seguido para conectar y encender el mechero de
Bunsen al comenzar la prctica.
El procedimiento que se sigui en cada una de las identificaciones a la flama, es el
dictado por la hoja de la prctica: humedecer la mina del lpiz dentro del vaso de precipitados
con HCl, y enseguida; colocar verticalmente (con el fin de tomar lo ms posible) la mina del
lpiz sobre la muestra de sal correspondiente en cada caso, y tomar un poco de la sal y llevarla
a la flama (Figura 1.4.), salvo en el caso del nitrato cobaltoso Co(NO
3
)
2
el cual se encontr en
forma lquida, por consiguiente, no fue necesario humedecer el grafito en HCl, sino que se
coloc directo a la flama.
Figura 1.4. Procedimiento a realizar en cada una de la pruebas de identificacin a la flama.
6
El aspecto de cada una de las sales se observa en la Figura 1.5. La mayora de las sales
eran polvos de color blanco, a excepcin del sulfato cprico (polvo de color azul) y del nitrato
de cobalto (lquido de color rojo).
NaCl
(Cloruro de sodio)
KCl
(Cloruro de potasio)
CaO
(xido de calcio)
Ba(NO
3
)
2
(Nitrato de bario)
MgO
(xido de magnesio)
Sr(NO
3
)
2
(Nitrato de estroncio)
CuSO
4
(Sulfato cprico)
Co(NO
3
)
2
(Nitrato cobaltoso)
LiCl
(Cloruro de litio)
Figura 1.5. Aspecto de las sales a emplear en la prctica.
7
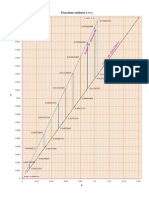
El color de cada catin se registr en el crculo cromtico (Figura 1.6) para la
elaboracin posterior de la Tabla 1.1 en la que se registra la coloracin de la flama, el color
absorbido, as como tambin las longitudes de onda observada y absorbida, estimadas para
cada catin.
Tabla 1.1 Registro del color de la flama y longitudes de onda de los cationes empleados en la
prctica.
Catin Color a la flama Color absorbido
observada
absorbida
Li
+
Rojo encendido Azul verdoso 697.14 520.63
Sr
++
Rojo Azul verdoso 687.5 516.25
Ca
++
Rojo naranja Azul 608.57 472.86
Co
++
Naranja rojizo Azul 602 466
Na
+
Naranja amarillento Azul 590 442
Mg
++
Amarillo claro Violeta 565 415
Ba
++
Verde amarillento Prpura rojizo 551 406.5
Cu
++
Azul verdoso Naranja rojizo 525 710
K
+
Violeta Amarillo verdoso 408 554
La observacin de la llama correspondiente al potasio se hizo a travs de un vidrio de
cobalto, para mejorar la nitidez del violeta al observar la flama. En el caso del xido de
magnesio (MgO) se observ una flama de color naranja casi todo el tiempo que se sostuvo la
sal a la flama, pero por unos instantes se not que se produjeron chispas de color amarillo muy
claro (el color de estas chispas es lo registrado en la Tabla 1.1.), casi blancas.
8
Figura 1.6. Ubicacin del color de la flama, de cada uno de los cationes de la prctica, en el
crculo cromtico para estimar su longitud de onda (nm).
400 800
710
620
580
570
560
533
525
490
430
420
410
Ba
K
Sr
Li
Ca
Cu
Co
Na
Mg
Cu
Co
Ca
Na
Sr
Li
Mg
K
Ba
Li K Cu
Sr Ca Co Mg Na Ba
9
Reacciones
Sodio:
+
NaCl
(s)
NaCl
(g)
Na
(g)
Cl
(g)
Na
(g)
Na
(g)
h
Na
(g)
*
+
Na
(g)
e Na
(g)
+
+
-
Sodio:
+
KCl
(s)
KCl
(g)
K
(g)
Cl
(g)
K
(g)
K
(g)
h
K
(g)
*
+
K
(g)
e K
(g)
+
+
-
Calcio:
+
CaO
(s)
CaO
(g)
Ca
(g)
O
2 (g)
Ca
(g)
Ca
(g)
h
Ca
(g)
*
+
Ca
(g)
e Ca
(g)
++
+
-
Litio:
+
LiCl
(s)
LiCl
(g)
Li
(g)
Cl
(g)
Li
(g)
Li
(g)
h
Li
(g)
*
+
Li
(g)
e Li
(g)
+
+
-
Magnesio:
+
MgO
(s)
MgO
(g)
Mg
(g)
O
2 (g)
Mg
(g)
Mg
(g)
h
Mg
(g)
*
+
10
Mg
(g)
e Mg
(g)
++
+
-
Bario:
+
Ba(NO
3
)
2 (s)
Ba
(g)
NO
2 (g)
Ba(NO
3
)
2 (g)
NO
(g) +
Ba
(g)
Ba
(g)
h
Ba
(g)
*
+
Ba
(g)
e Ba
(g)
++
+
-
Cobalto:
+
Co(NO
3
)
2 (l)
Co
(g)
NO
2 (g)
Co(NO
3
)
2 (g)
NO
(g) +
Co
(g)
Co
(g)
h
Co
(g)
*
+
Co
(g)
e Co
(g)
++
+
-
Estroncio:
+
Sr(NO
3
)
2 (s)
Sr
(g)
NO
2 (g)
Sr(NO
3
)
2 (g)
NO
(g) +
Sr
(g)
Sr
(g)
h
Sr
(g)
*
+
Cobre:
Cu
(g)
Cu
(g)
h
Cu
(g)
*
+
Conclusiones
Al trmino de sta prctica llegamos a las siguientes conclusiones:
Pudimos observar las coloraciones a la flama gracias al incremento de energa,
otorgado por la combustin a la llama de las sales, que produjo un estado de excitacin en los
que los tomos que al regresar al estado basal emiten una radiacin de luz visible (coloracin a
Sr
(g)
e Sr
(g)
++
+
-
Cu
(g)
e Cu
(g)
++
+
-
11
la flama) y otra radiacin la cual no podemos ver ya que no est en el intervalo de la luz
visible.
Cada catin emiti una radiacin de color diferente, por lo que es un buen mtodo de
identificacin para los cationes empleados en la prctica, dado a que es muy fcil, rpido y
econmico; con excepcin del magnesio (Mg) el cual no se vio claramente la coloracin de la
flama, por lo que no es un mtodo que utilizaramos si queremos identificar magnesio.
El uso del vidrio de cobalto nos sirvi como filtro de la radiacin amarilla-naranja que
produce el sodio, por consiguiente nos permiti ver claramente la coloracin violeta del
potasio.
Bibliografa
Espectro de la radiacin, disponible en lnea en: http://personales.ya.com/casachi/did/er.htm,
a 22 de febrero de 2011
Ensayos a la flama-laboratorio virtual-docencia-departamento de qumica inorgnica,
disponible en lnea en http://www.ua.es/depto/dqino/docencia/lab_virtual/llama/index.html, a
22 de febrero de 2011.
Fritz, J.S. & Schenk, G.H (1993). Qumica analtica cuantitativa. Mxico, D.F.: Editorial
Limusa, S.A de C.V.
Douglas Skoog. Interamerican. Segunda edicin analita qumico en intrumental Harold
Walton, RevertSA Analytical Procedure errow M ,99, pg 8,
Grupo FCQ: prctica 5 Espectroscopia (qumica), disponible en lnea en http://
uachfcqqbp.blogspot.com/2007/09/ptactrica-5-espectroscopia-quimica.html 22 de febrero de
2011.
12
You might also like
- Prontuario Tamsa Tablas TuberiasDocument219 pagesProntuario Tamsa Tablas TuberiasMissaelNo ratings yet
- TRAZOS BÁSICOS en El DibujoDocument45 pagesTRAZOS BÁSICOS en El DibujoDavid BarreraNo ratings yet
- Problema 6Document10 pagesProblema 6José RiveraNo ratings yet
- Tecnicas Basicas de Bisuteria Paso A PasoDocument151 pagesTecnicas Basicas de Bisuteria Paso A PasoSofi LoyolaNo ratings yet
- 00 Terapia Aura Soma 16Document17 pages00 Terapia Aura Soma 16antonio jose ortigosaNo ratings yet
- Tuberia HDPE Material PE4710-PE100 PDFDocument13 pagesTuberia HDPE Material PE4710-PE100 PDFYnuzne100% (1)
- Extracto Color y SignificadoDocument22 pagesExtracto Color y SignificadoAlejandro G del Pliego100% (1)
- Rhino Level 2 v5 PDFDocument192 pagesRhino Level 2 v5 PDFDavid Vidal100% (1)
- Ondas electromagnéticas: efecto Doppler y tipos de lentes y espejosDocument5 pagesOndas electromagnéticas: efecto Doppler y tipos de lentes y espejosantonio lopez manzoNo ratings yet
- Tabla Propiedades Fisicas Practica 3Document1 pageTabla Propiedades Fisicas Practica 3José RiveraNo ratings yet
- Grafica Reactores PDFDocument1 pageGrafica Reactores PDFJosé RiveraNo ratings yet
- De Compras English A1Document5 pagesDe Compras English A1José Rivera100% (1)
- Grafica ReactoresDocument1 pageGrafica ReactoresJosé RiveraNo ratings yet
- LinksDocument1 pageLinksJosé RiveraNo ratings yet
- Gráficas Tarea AbsorciónDocument3 pagesGráficas Tarea AbsorciónJosé RiveraNo ratings yet
- 02 Criterios de Evaluacion UND1 ACT 2Document1 page02 Criterios de Evaluacion UND1 ACT 2José RiveraNo ratings yet
- Calendar I oDocument1 pageCalendar I oJosé RiveraNo ratings yet
- Madera: origen, propiedades y usosDocument19 pagesMadera: origen, propiedades y usosdavamon12No ratings yet
- Oda U1Document3 pagesOda U1José RiveraNo ratings yet
- Aplicación Del Método de Punto de Burbuja en El Diseño de Columnas de DestilaciónDocument6 pagesAplicación Del Método de Punto de Burbuja en El Diseño de Columnas de DestilaciónSasha EspinosaNo ratings yet
- Word CursoDocument16 pagesWord CursoMarco A VegoNo ratings yet
- Presentación 1Document1 pagePresentación 1José RiveraNo ratings yet
- Moldeo Por SopladoDocument2 pagesMoldeo Por SopladoJosé RiveraNo ratings yet
- Grafica ExamenDocument1 pageGrafica ExamenJosé RiveraNo ratings yet
- Gráficas Tarea AbsorciónDocument3 pagesGráficas Tarea AbsorciónJosé RiveraNo ratings yet
- Metodo 1 F DDocument6 pagesMetodo 1 F DJosé RiveraNo ratings yet
- Aceite CastorDocument3 pagesAceite CastorJosé RiveraNo ratings yet
- Tarea 1 Unidad 1 Sintesis y Opt Sept 2015Document11 pagesTarea 1 Unidad 1 Sintesis y Opt Sept 2015José RiveraNo ratings yet
- Presentación 1Document4 pagesPresentación 1José RiveraNo ratings yet
- OP1Document3 pagesOP1José RiveraNo ratings yet
- Say BoltDocument3 pagesSay BoltJosé RiveraNo ratings yet
- Practica 5 - Conductividad TermicaDocument16 pagesPractica 5 - Conductividad TermicaMiguel Angel C. Greer80% (5)
- Examen Regresion PolinomialDocument26 pagesExamen Regresion PolinomialJosé RiveraNo ratings yet
- Grupos Química Verano 2015Document2 pagesGrupos Química Verano 2015José RiveraNo ratings yet
- SeparadorDocument5 pagesSeparadorJosé RiveraNo ratings yet
- Diagrama de Flujo Pract 8 - Lab 2Document2 pagesDiagrama de Flujo Pract 8 - Lab 2José RiveraNo ratings yet
- ReactorDocument1 pageReactorJosé RiveraNo ratings yet
- Gráficas Tarea AbsorciónDocument3 pagesGráficas Tarea AbsorciónJosé RiveraNo ratings yet
- Cómo Decorar en Chile o Como Huir de La Uniformidad de Karla RochaDocument97 pagesCómo Decorar en Chile o Como Huir de La Uniformidad de Karla Rochamagdalena contreras100% (1)
- Caracteristicas Organolepticas PDFDocument40 pagesCaracteristicas Organolepticas PDFKlipton Jhon Aquino HerreraNo ratings yet
- Guía Técnica Iluminación para Edificios Históricos, Monumentales y ReligiososDocument30 pagesGuía Técnica Iluminación para Edificios Históricos, Monumentales y ReligiososFrida Victoria LaraNo ratings yet
- Capitulo II.1-MSVDSDocument43 pagesCapitulo II.1-MSVDSMagda GonzalezNo ratings yet
- s21 Prim 1 Guia Dia 3 1 PDFDocument6 pagess21 Prim 1 Guia Dia 3 1 PDFluis anthony jamill avila sanchezNo ratings yet
- Determinacion Espectrofotometrica de Kmno 4 Cuso 4 y K 2 CR 2 o 7Document5 pagesDeterminacion Espectrofotometrica de Kmno 4 Cuso 4 y K 2 CR 2 o 7Maria Luisa Cutipa TuscoNo ratings yet
- Aubrey y Maturin 09 - El Puerto de La Traicion - Ptrick O'BrienDocument621 pagesAubrey y Maturin 09 - El Puerto de La Traicion - Ptrick O'BrienperdelwowNo ratings yet
- TN Peluqueria 637307Document44 pagesTN Peluqueria 637307Simon ZuluagaNo ratings yet
- Texto de Gestión de A+bDocument138 pagesTexto de Gestión de A+bLore DelisNo ratings yet
- Introduccion Herramientas Edicion Imagenes y Creacion VectorialDocument15 pagesIntroduccion Herramientas Edicion Imagenes y Creacion VectoriallomasalNo ratings yet
- Ejemplo de ProyectoDocument18 pagesEjemplo de ProyectoJoselyne DiazNo ratings yet
- TP Diagramacion 20X20 - 2012Document4 pagesTP Diagramacion 20X20 - 2012Claudina DabadieNo ratings yet
- 6ºgrado - Ética y Valores - I Bimestre-Para ImprimirDocument21 pages6ºgrado - Ética y Valores - I Bimestre-Para ImprimirAllison Hiyori Guzman CasazolaNo ratings yet
- La búsqueda de la verdadDocument99 pagesLa búsqueda de la verdadlsilvalopezNo ratings yet
- Ciencias Sociales 1BAJADocument52 pagesCiencias Sociales 1BAJAAlex CentenoNo ratings yet
- El Color de La Cerveza PDFDocument5 pagesEl Color de La Cerveza PDFPablo CariagaNo ratings yet
- Diseño Del Mensaje Publicitario-Conciencia CiudadanaDocument9 pagesDiseño Del Mensaje Publicitario-Conciencia CiudadanaJose Antonio PulgarNo ratings yet
- Línea GráficaDocument6 pagesLínea GráficaJhonatan Capcha PonceNo ratings yet
- Iluminación fundamentos guíaDocument15 pagesIluminación fundamentos guíaJimena Encinas López0% (1)
- Cuento Camaleon para Explicar EmocionesDocument4 pagesCuento Camaleon para Explicar EmocionesDiana La MarcianaNo ratings yet
- Bingo generador aleatorioDocument2 pagesBingo generador aleatoriohopamo19760% (1)
- PapelMuralSodimacDocument1 pagePapelMuralSodimacCarla DuarteNo ratings yet