Professional Documents
Culture Documents
Fisicoquímica Básica
Uploaded by
tmuzzioCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Fisicoquímica Básica
Uploaded by
tmuzzioCopyright:
Available Formats
Fisicoqumica II
UNICIT
Sistemas y estado
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
Termodinmica
La Termodinmica se ocupa de las relaciones entre el calor y el
trabajo.
Se basa en principios generales de la naturaleza. Mediante
razonamiento lgico es posible relacionar muchas propiedades
observables de la materia: Coeficientes de dilatacin,
compresibilidades, calores especficos, presiones de vapor y calores
de transformacin.
La Termodinmica no formula hiptesis sobre la estructura de la
materia. Es una ciencia experimental y las frmulas termodinmicas
tienen la misma validez general que los principios de los cuales
derivan.
El estudio de la Fisicoqumica consiste en gran parte, en en la
aplicacin de los principios de la Termodinmica a la Qumica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Energa
Concepto introducido por primera vez por
Newton en sus hiptesis sobre las energas
cinticas y potencial.
La energa es una magnitud escalar que no
puede medirse directamente.
Es una abstraccin matemtica que tiene
relacin funcional con otras variables o
coordenadas que tienen una interpretacin
fsica y pueden medirse.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Energa
La energa puede clasificarse
Energa en transicin debido a una diferencia de a de potencial:
gradientes de fuerza, temperatura y potencial elctrico dan
lugar a la transferencia de trabajo mecnico, calor y energa
elctrica.
Energa interna: son ejemplos de este tipo las energas
potencial, cintica, qumica y atmica
La termodinmica se relaciona con los cambios de energa
ms que con las energas absolutas.
En la mayor parte de los casos no hay forma de medir las
energas absolutas, pero como los problemas
termodinmicos generalmente exigen slo el conocimiento
del cambio de energa, el nivel cero de esta magnitud pude
establecerse arbitrariamente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Sistema y ambiente
Un sistema es una regin establecida del
espacio o una cantidad finita de materia
encerrada por lmites reales o imaginarios.
Los sistemas de inters termodinmicos son
finitos y el punto de vista empleado es el
macroscpico en lugar de microscpico.
Todo lo que est fuera de los lmites del
sistema se denomina los alrededores, entorno
o medio ambiente
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
El sistema y su entorno
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Tipos de sistemas
Hay muchos tipos de sistemas, en nuestro caso
trataremos con sistemas termodinmicos.
Clasificaremos los sistemas de acuerdo a la forma en
que interactan con los alrededores respecto de dos
variables:
Materia: un sistema puede intercambiar o no materia con
sus alrededores.
Energa: un sistema puede intercambiar o no energa con
sus alrededores. La energa puede intercambiarse como
calor o trabajo.
Los sistemas pueden intercambiar materia, energa,
ambos o ninguno de los dos con los alrededores.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Tipos de sistemas
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Ejemplo de sistema
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Lmite del
Sistema
Alrededores
Quemador
Ejemplo de sistema con lmite mvil
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
Lmite del
Sistema
Estado de un sistema
Un sistema aislado puede estar sujeto a cambios
internos que pueden detectarse con instrumentos
como termmetros o manmetros. Sin embargo, se
observa que esos cambios dejan de producirse al cabo
de un tiempo y decimos que el sistema ha alcanzado
una condicin de equilibrio interno.
Un sistema cerrado que puede intercambiar energa
con el ambiente que lo rodea puede alcanzar una
condicin esttica final de modo que no solo est en
equilibrio interno, sino tambin en equilibrio externo
con su ambiente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
Estado de un sistema
Un estado de equilibrio representa una condicin
particularmente simple de un sistema, sujeto a
una descripcin matemtica precisa porque en tal
estado el sistema presenta un conjunto de
propiedades identificables y reproducible.
La palabra estado representa la totalidad de las
propiedades macroscpicas asociadas al sistema.
Algunas se detectan fcilmente con instrumentos,
otras se reconocen nicamente de manera
indirecta.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Estado de un sistema
El nmero de propiedades que arbitrariamente
pueden tomarse dando ciertos valores para fijar
el estado del sistema depende de la naturaleza
del sistema.
Un sistema en equilibrio termodinmico presenta
un conjunto de propiedades fijas que son
independientes del tiempo y por tanto pueden
ser medidas con precisin. Adems tales estados
son reproducibles fcilmente de forma
independiente del tiempo y lugar.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Propiedades de un sistema
Las propiedades de un sistema son aquellos
atributos fsicos que se perciben por los sentidos
o que pueden hacerse perceptibles mediante
ciertos mtodos experimentales de investigacin.
Podemos distinguir dos clases:
Medibles: como presin, temperatura, volumen, a las
que se les puede asignar, por comparacin directa o
indirecta con un patrn, un valor numrico.
No medibles: tipo de sustancias que componen el
sistema, estado de agregacin de sus partes.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Propiedades de un sistema
Propiedades extensivas
Una propiedad se denomina extensiva si su valor
depende del tamao o extensin del sistema.
Ejemplos: masa, volumen, longitud, energa.
Propiedades intensivas
Una propiedad se denomina intensiva si su valor
NO depende del tamao o extensin del sistema.
Ejemplos: temperatura, densidad, calor especfico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Procesos
Transicin en la cual un sistema cambia desde
un estado inicial a otro final. Se describe por la
trayectoria termodinmica seguida por el
sistema al experimentar el cambio de estado.
Un proceso ideal o cuasi-esttico es aquel en
que el estado del sistema se desva del
equilibrio slo por cantidades infinitesimales a
lo largo del proceso.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Cambio de estado de un sistema
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
Procesos
Algunos procesos se describen por el hecho que una propiedad se
mantiene constante. El prefijo iso se usa para indicarlos:
Isotrmico: temperatura constante
Isobrico: presin constante
Isocrico: volumen constante
Si el proceso no implica interacciones de trabajo se llama de trabajo
nulo.
Si el proceso no implica interaccin calorfica se denomina
adiabtico.
Si el sistema luego de verificar una serie de procesos retorna a su
estado original, de modo que las propiedades termodinmicas del
sistema final son las mismas que al principio, se dice que ha
recorrido un ciclo termodinmico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Sistemas PVT
Sistema termodinmico ms sencillo
Fluido isotrpico, no influenciado por reacciones
qumicas, no influenciado por campos externos
Se describen mediante tres coordenadas
mensurables: P, T y V.
Al fijar dos cualquiera, la tercera se determina.
Luego debe existir una ecuacin de estado que
relacione estas coordenadas para estados de
equilibrio
, , = 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Sistemas PVT
Ejemplo ms simple es la ecuacin de un gas
ideal:
=
Donde V es el volumen, P la presin, n el
nmero de moles de sustancia, R la constante
universal de los gases y T la temperatura
absoluta.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Superficie PVT para un gas ideal
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
Superficie PVT para una sustancia pura
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Temperatura
La temperatura es una propiedad de la que
tenemos una percepcin sensorial, pero que
es difcil de definir en forma simple.
El termmetro nos da una medida numrica
del grado de calor.
Algunos termmetros:
Termmetro de alcohol, termmetro de mercurio,
termocupla, termmetro de resistencia de platino,
termistor, pirmetro ptico
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
Temperatura
Relacin entre temperatura y energa cintica
media de las molculas de un gas ideal:
1
2
2
=
3
2
Donde
m= masa de una molcula
2
= velocidad cuadrtica media
=
0
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Termmetro de gas a volumen
constante
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Se pueden construir escalas de temperatura con slo
un punto fijo. En esos casos, la relacin entre dos
temperaturas empricas viene dada por la razn de los
valores de la propiedad termomtrica que se utilice. A
fin de obtener un valor numrico para una de estas
temperaturas, se atribuye un valor arbitrario a una de
ellas, que se escoge como punto de referencia,
,
tal
que :
Siendo la propiedad termodinmica medida y
su
valor de referencia.
Termmetro de gas a volumen
constante
Un termmetro que
tiene un papel
importante en el
desarrollo histrico de
la Termodinmica es el
termmetro de gas a
volumen constante.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
Termmetro de gas a volumen
constante
Experimento:
Una determinada cantidad del gas, por ejemplo aire, se
introduce en el bulbo del termmetro.
Se pone el bulbo en contacto con un recipiente en el punto
de vapor del agua. El volumen se mantiene constante
manejando el mercurio.
Se apunta la presin, por ejemplo
.
A continuacin se llevaba a un recipiente en el punto de
fusin del agua. Se apunta la presin, por ejemplo
.
As se tiene un primer par
.
Se extrae algo de gas y se repite la operacin obtenindose
otro par,
. Al haber menos gas las presiones son
menores que las anteriores
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
Termmetro de gas a volumen
constante
Experimento:
Esta operacin se repite varias veces con cantidades
de gas cada vez menores, obtenindose
.
Al tomar el lmite de la relacin
cuando
tiende a cero, se encuentra que esa relacin tiende al
valor 1.3661.
Para diferentes gases, si bien las curvas son diferentes,
todas tienden al mismo valor lmite.
Este comportamiento universal permite usar gases a
bajas presiones como sustancias termomtricas.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
Termmetro de gas a volumen
constante
Podemos determinar la temperatura de un
cuerpo usando el punto triple del agua como
valor de referencia, al que se le asigna la
temperatura
3
= 273.16 , y la ecuacin
Se obtiene una serie de valores
3,
,
3
,
, y de acuerdo a
lo anterior
=
3
lim
3
0
3
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
29
Ejemplo 1
En la Tabla , el nmero de la parte izquierda representa la presin
de un gas en el bulbo de un termmetro de gas a volumen
constante (corregida por el espacio muerto, dilatacin del vidrio,
etc.) cuando el bulbo est sumergido en una clula del punto triple
del agua. La columna de la derecha representa las correspondientes
lecturas de la presin cuando el bulbo est rodeado con un material
a una temperatura constante desconocida. Calcular la temperatura
T de ese material en la escala del gas ideal. (Dar cinco cifras
significativas).
P
TP
/kPa
P /kPa
133,32 204,69
99,992 153,54
66,661 102,37
33,331 51,190
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Solucin Ejemplo 1
Para resolver este problema usamos la
ecuacin
=
3
lim
3
0
3
Sabemos que
3
= 273.16K , debemos
encontrar el lmite cuando
3
0.
Esto lo hacemos graficando
3
vs
3
y
encontrando el intercepto cuando
3
=0.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Solucin Ejemplo 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
En la tabla siguiente se muestran los valores
reordenados de las presiones y de la razn
P/P3.
P3 (kPa) P (kPa) P/P3
33.331 51.190 1.535808
66.661 102.370 1.535681
99.992 153.540 1.535523
133.320 204.690 1.535329
Solucin Ejemplo 1
A continuacin se presenta el grfico de P/P3
vs P3
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
y = -4.7843E-06x + 1.5360E+00
R = 9.9115E-01
1.5352
1.5353
1.5354
1.5355
1.5356
1.5357
1.5358
1.5359
1.536
1.5361
-40.000 -20.000 0.000 20.000 40.000 60.000 80.000 100.000 120.000 140.000 160.000
P
/
P
3
P3
Series1
Linear (Series1)
Solucin Ejemplo 1
Al usar una regresin lineal para correlacionar
los datos llegamos a
= 4.7843 10
6
+1.5360
con un coeficiente de correlacin
2
= 0.99115
Usando una regresin polinomial de grado 2
llegamos a:
= 1.5156 10
8
2
2.2586 10
6
+1.53590
2
= 0.99999
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
Solucin Ejemplo 1
El valor del coeficiente de regresin es mejor para una
regresin cuadrtica que para una lineal. Esto porque
los datos forman una ligera curva que tiende a ser
completamente lineal a medida que se acerca a cero.
El valor del intercepto es muy similar en ambos casos.
Podemos decir entonces:
lim
3
0
3
= 1.5360
Y
= 273.16 1.5360 = 419.57
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
35
Densidad
En fsica y qumica, la densidad (smbolo ) es
una magnitud escalar referida a la cantidad de
masa contenida en un determinado volumen
de una sustancia
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Presin
La presin es la razn entre la componente
normal de una fuerza a una superficie y el
rea de esa superficie.
Es una magnitud escalar.
Presin atmosfrica estndar: presin
producida por una columna de mercurio de
760 mm de altura.
1 = 14.696 = 1.01325 = 1.01325 10
5
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
Presin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Trabajo Mecnico
Trabajo en Termodinmica siempre representa
intercambio de energa entre el sistema y el
ambiente.
El trabajo mecnico sucede cuando una fuerza
actuando sobre un sistema se mueve una
distancia
=
Donde F es el componente dela fuerza actuando en
la direccin de dl.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
Trabajo Mecnico
En forma diferencial
=
En termodinmica a menudo encontramos el
trabajo realizado por una fuerza actuando
sobre un rea, es decir por una presin
actuando sobre un volumen V, en ese caso
=
Donde P es la presin ejercida en forma externa
al sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Ejemplo 2
Se confina gas dentro de un cilindro horizontal
inicialmente a volumen
mediante un pistn sin
rozamiento mantenido en su posicin por pasadores.
Cuando el pistn se deja en libertad se desplaza hacia
afuera por la presin interna del gas que acta sobre la
cara interna del pistn. Una presin constante acta
sobre la cara externa del pistn y opone resistencia al
movimiento de este. Calcule el trabajo del sistema
conformado por el pistn, el cilindro y el gas a un
volumen
, para el cual el pistn se encuentra en
posicin de equilibrio, siendo la presin interna del gas
igual a la presin externa .
Cual es el trabajo si = 20
= 0.5
3
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Trabajo Mecnico
Sistemas descritos por coordenadas diferents
a PVT, que estn sujetos a trabajo realizado
por fuerzas diferentes de la presin son
tambin de importancia. Trabajo elctrico,
trabajo magntico, trabajo de cambio del rea
superficial, etc. El trabajo total puede
expresarse como:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
42
Calor
El calor es energa en trnsito a travs del
lmite que separa un sistema de su ambiente.
La transferencia de calor resulta de una
diferencia de temperaturas entre el sistema y
el medio que lo rodea.
De acuerdo a la convencin de signos al calor
suministrado a un sistema se le asigna un
nmero positivo mientras que al extrado del
sistema un nmero negativo.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
43
Reversibilidad
Un proceso es reversible si su direccin puede
invertirse a cualquier estado mediante un
cambio infinitesimal de las condiciones
externas
Ejemplo: Discusin de un proceso adiabtico
Ejemplo: discusin de un proceso isotrmico
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
44
Proceso adiabtico
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
45
Proceso isotrmico
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
46
Ejemplo 3
Se desea calcular el trabajo realizado cuando
un gas ideal se expande isotrmica y
reversiblemente en un dispositivo cilindro-
pistn.
Cual es el trabajo para la expansin, por kg-
mol, de gas a 300K a partir de una presin
inicial de 10 at a una presin final de 1 at.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
47
Solucin Ejemplo 3
El proceso es reversible mecnicamente, por lo que la
presin la podemos expresar mediante la ecuacin del
gas ideal:
=
=
La expresin diferencial para trabajo mecnico es:
=
Por lo que:
= =
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
48
Solucin Ejemplo 3
Integrando desde el estado inicial(i) hasta el final(f) tenemos:
=
Dado que el proceso es isotrmico, PV=constante y
Luego
Entonces:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
49
Solucin Ejemplo 3
Las condiciones del ejemplo dicen:
= 300;
= 10;
= 1
Tenemos que
= 8314.34
= 8314.34 300
10
1
= 5,743,342
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
50
Fisicoqumica II
UNICIT
Leyes de la Termodinmica
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
PRIMERA LEY DE LA
TERMODINMICA
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Primera Ley de la Termodinmica
Para un sistema cerrado afirma que el cambio total de
energa del sistema es igual al calor transferido al
sistema menos el trabajo realizado por el sistema
=
=
+
La funcin de energa interna U corresponde a las
energas cintica y potencial de las molculas, tomos
y partculas subatmicas que constituyen el sistema a
escala microscpica. No podemos conocer valores
absolutos de U, pero podemos encontrar los cambios
de U, U.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Primera Ley de la Termodinmica
Frecuentemente las energas cinticas y
potencial de un sistema permanecen
constantes, entonces,
=
En forma diferencial
=
Para un proceso adiabtico, Q=0, entonces,
=
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Entalpa
Las funciones termodinmicas especiales se han
definido por conveniencia.
La funcin ms sencilla es la entalpa y se define
como:
= +
= +
Para un sistema PVT sometido proceso
mecnicamente reversible a presin constante
= +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Entalpa
Pero para un proceso mecnicamente reversible
se tiene que:
=
Sabemos que:
=
Reemplazando dU y W en la expresin para
entalpa:
= + =
Para un proceso finito:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Ejemplo 1
Dentro de un cilindro en una atmsfera de oxgeno
puro se tiene lana de acero. El cilindro se tapa con un
pistn sin rozamiento que mantiene la presin de
oxgeno constante en 1 (atm). El hierro de la lana de
acero reacciona muy lentamente para formar Fe2O3.
Durante el proceso se remueve el calor del aparato y se
mantiene la temperatura constante en 25C. Se tiene
que en la reaccin de dos moles de hierro
2 +
3
2
2
2
3
Se remueven 198500 cal. Calcular Q y W en el proceso y
U del sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Ejemplo 1
Tanto el Fe como el Fe2O3 son slidos. Por lo
tanto podemos asumir que el volumen que
ocupan es despreciable comparado con el del
oxgeno gaseoso. Luego, podemos suponer
que el volumen del oxgeno corresponde al
volumen total del sistema,
. Asumimos
tambin que se trata de un gas ideal. Entonces
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Ejemplo 1
Entonces
Donde n son los moles de oxgeno gaseoso
presentes.
Durante el proceso se mantienen P y T constantes y
slo cambia n, de modo que el cambio total de
volumen es
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Ejemplo 1
Dado que la presin es constante, el trabajo
realizado es
=
=
Segn la ecuacin se consumen
3
2
moles de oxgeno
y =
3
2
. Entonces
= 1.987
298
3
2
= 890 3720
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
Ejemplo 1
El signo menos indica que el pistn realiza
trabajo sobre el sistema.
Se sabe que Q=-198,500 (cal) o -830,500 (J).
= = 198,500 +890 =
197610 826,800 .
Esta disminucin en la energa interna refleja
los cambios en energas de enlaces producidos
por la reaccin qumica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
Capacidad calorfica
Para procesos reversibles en sistemas cerrados
PVT, la capacidad calorfica se define en forma
general como:
Para los sistemas PVT se usan generalmente dos
tipos de capacidad calorfica. Estas son
,
capacidad calorfica a volumen constante y
,
capacidad calorfica a presin constante.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Capacidad calorfica
Por definicin
Un sistema cerrado no puede realizar trabajo,
por lo que = y
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Capacidad calorfica
Similarmente
En un sistema cerrado PVT, para un proceso
reversible a presin constante = y
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Capacidad calorfica
Tambin podemos escribir las ecuaciones
anteriores como:
=
Estas ecuaciones relacionan las propiedades y
no dependen de la trayectoria. Son vlidas
para cualquier cambio entre estados de
equilibrio bajo las restricciones indicadas.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Capacidad calorfica de un gas ideal
La energa interna de un sistema cerrado PVT
puede considerarse como funcin de T y V.
= ,
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Capacidad calorfica de un gas ideal
Los valores de
deben determinarse experimentalmente. Sin
embargo, para un gas ideal la energa interna depende slo de la
temperatura, por lo que
= 0.
Luego para un gas ideal
=
Para un gas ideal U y Cv son funciones nicamente de la
temperatura.
Para un gas ideal los valores de Cp y Cv son:
= 5
= 3
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
Ejemplo 2
Demostrar que para un gas ideal H es una
funcin de la temperatura. Encontrar la
relacin entre Cp y Cv.
Usaremos propiedades especficas referidas a
la cantidad de moles. Por definicin:
= + = +
Diferenciando H respecto de T:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Ejemplo 2
Usamos derivadas totales porque U y PV son
funcin nicamente de T.
Luego
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Ejemplo 2
Por otro lado
=
Luego
+
La relacin entre las capacidades calorficas se
expresa como
=
= 1.67
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Ejemplo 3
Demostrar que para un gas ideal con
capacidades calorficas constantes sometido a
una expansin o compresin adiabtica
reversible se cumple que:
1
=
1
2
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
Ejemplo 3
Para un proceso adiabtico se cumple que
= 0. Entonces:
=
Para un proceso mecnicamente reversible
=
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Ejemplo 3
Luego
Sabemos que
= 1
= 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
Ejemplo 3
Entonces
= 1
Integrando entre los estados 1 y 2 con constante
tenemos
1
= 1
2
1
=
2
1
1
=
1
2
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Ejemplo 4
Si un gas ideal monoatmico se expande
reversible y adiabticamente desde
1
= 450 y
1
= 3 hasta un volumen final
2
= 5 , determine la temperatura final y el
trabajo realizado en el proceso.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Ejemplo 4
Para un gas ideal tenemos que:
1
=
1
2
1
Donde =
= 1.67
2
=
1
2
1
= 450
3
5
1.671
= 320
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
Ejemplo 4
Dado que el proceso es adiabtico, = 0.
Luego
= =
= =
= 3
320 450 = 390
Que significa el valor positivo de W?
Como calculamos el H?
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
SEGUNDA LEY DE LA
TERMODINMICA
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
Presentacin axiomtica de la primera
ley
Axioma 1
Existe una forma de energa, conocida como
energa interna, que es una propiedad intrnseca
de un sistema, la que est relacionada
funcionalmente con las coordenadas medibles
que caracterizan al sistema. Para un sistema
cerrado que no est en movimiento, los cambios
en esta propiedad estn dados por:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
29
Presentacin axiomtica de la primera
ley
Axioma 2
La energa total de cualquier sistema y de sus alrededores,
considerados en conjunto, se conserva.
El primer axioma afirma la existencia de una funcin
llamada energa interna y provee una relacin que la
liga a cantidades medibles. Esa ecuacin no define la
energa interna, no existe definicin. Lo que tenemos
es una forma de calcular cambios en esta funcin; no
podemos determinar valores absolutos.
El segundo axioma depende del primero y es una de las
leyes fundamentales de la fsica clsica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Presentacin axiomtica de la segunda
ley
Axioma 3
Existe una propiedad denominada entropa, S, que
es una propiedad intrnseca de un sistema,
relacionada funcionalmente con las coordenadas
que caracterizan al sistema. Para un proceso
reversible, los cambios en esta propiedad estn
dados por
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Presentacin axiomtica de la segunda
ley
Axioma 4
El cambio de entropa de cualquier sistema y sus alrededores
considerados en conjunto es siempre positivo y se acerca a cero
para cualquier proceso que se acerca a la reversibilidad.
El tercer axioma asegura la existencia de la entropa y proporciona
una forma de calcular el cambio en sus valores a partir de
cantidades medibles, sin embargo no proporciona una definicin.
La entropa es otro concepto primitivo.
El cuarto axioma, la segunda ley de la termodinmica, es una ley de
conservacin slo para procesos reversibles que son desconocidos
en la naturaleza. Todos los procesos naturales conllevan aumento
en la entropa, por lo que se expresa matemticamente como
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
Ejemplo 5
Demostrar que cualquier flujo de calor entre
dos depsitos de calor a temperaturas
donde
>
, debe ser del depsito ms
caliente al ms fro.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
Ejemplo 5
Un depsito de calor es un cuerpo capaz de absorber o
desprender cantidades ilimitadas de calor sin ningn
cambio de temperatura. La atmsfera y los ocanos se
aproximan a lo que son los depsitos de calor, por lo
general utilizados como sumideros de calor.
Cuando se suministra o extrae una cantidad finita de
calor de un depsito de calor, este sufre un cambio
finito de entropa a temperatura constante.
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
Ejemplo 5
Supongamos que una cantidad de calor Q
pasa desde un depsito a otro, la magnitud de
Q es la misma para ambos depsitos, pero
son de signos opuestos, ya que el calor
suministrado a un depsito, considerado
positivo, es el calor extrado del otro,
considerado negativo. Luego
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
35
Ejemplo 5
Los cambios de entropa sern
Por tanto
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Ejemplo 5
De acuerdo a la segunda ley,
debe ser
positivo. Por lo tanto
> 0
Segn el enunciado del problema,
>
,
entonces
debe ser positivo y por consiguiente
debe representar al calor suministrado al depsito
a
. Este calor debe fluir desde el depsito a
temperatura ms alta al depsito que est a
temperatura ms baja, resultado que concuerda
con la experiencia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
Ejemplo 6
Que restricciones imponen las leyes de la
termodinmica a la produccin de trabajo por
medio de un dispositivo que permanece
inmodificable y que intercambia calor con los
dos depsitos del ejemplo anterior? Tal
dispositivo se conoce como mquina trmica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Ejemplo 6
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
Recipiente caliente
Recipiente caliente
Recipiente fro
Recipiente fro
Mquina
Trmica
Bomba
De
Calor
Ejemplo 6
Supongamos que el mecanismo intercambia calor
con el depsito a
con el depsito a
. Los smbolos
se refieren a los
depsitos de calor y los signos en sus valores
numricos se determinan segn se suministre o
se retire calor de los depsitos de calor.
Luego
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Ejemplo 6
Respecto del dispositivo o mquina:
La cantidad de calor que ingresa es numricamente
igual que la que sale del depsito a
, pero su signo
es el opuesto ya que ingresa a la mquina. La cantidad
de calor que sale a su vez es la misma que la que
ingresa al depsito a
, pero con signo opuesto ya
que sale de la mquina.
Si
son los intercambios de calor respecto
de la mquina, tenemos:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Ejemplo 6
El cambio total de entropa que resulta de
cualquier proceso que involucre a la mquina
y los depsitos de calor es:
Dado que la mquina no cambia,
= 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
42
Ejemplo 6
La primera ley aplicada a la mquina tiene la
forma
=
Donde es el cambio de energa interna de la
mquina, es el trabajo que realiza la mquina y
es el calor transferido con respecto de la mquina. Por
lo tanto:
Como la mquina es inmodificable,
= 0.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
43
Ejemplo 6
Esto significa que
=
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
44
Ejemplo 6
=
1
La mquina produce trabajo, , que debe ser
positivo, con un valor lmite inferior cero.
Si = 0, tenemos la ecuacin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
45
Ejemplo 6
=
1
La otra situacin lmite la representa un proceso
reversible, en cuyo caso
= 0 de acuerdo
a la segunda ley. En este caso toma el valor
mximo para los valores de
.
=
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
46
Ejemplo 6
Combinando
=
1
Con
=
Obtenemos
= 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
47
Ejemplo 6
Estas ecuaciones se conocen como ecuaciones de Carnot, y se
aplican a todas las mquinas trmicas que funcionan entre
niveles fijos de temperatura, es decir Mquinas de Carnot.
Nicolas Lonard Sadi Carnot (Pars, 1 de junio de 1796 - 24 de agosto
de 1832), normalmente llamado Sadi Carnot fue un ingeniero francs
pionero en el estudio de la Termodinmica. Se le reconoce hoy como el
fundador de la Termodinmica. Era hijo de Lazare Carnot, conocido
como el Gran Carnot, y to de Marie Franois Sadi Carnot, que lleg a
ser Presidente de la Repblica Francesa. Licenciado en la Escuela
Politcnica, en 1824 public su obra maestra: "Reflexiones sobre la
potencia motriz del fuego y sobre las mquinas adecuadas para
desarrollar esta potencia", donde expuso las ideas que daran forma al
segundo principio de la termodinmica. Estos trabajos, poco
comprendidos por parte de sus contemporneos, fueron ms tarde
conocidos en Alemania por Rudolf Clausius (que fue quien los difundi)
y por William Thomson (Lord Kelvin) en el Reino Unido.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
48
Mquinas y bombas trmicas
La expresin
= 1
A menudo se escribe como
= 1
=
Y representa la eficiencia trmica de una
mquina trmica de Carnot.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
49
Mquinas y bombas trmicas
Esta expresin nos indica que la nica forma
de convertir completamente el calor en
trabajo es que la temperatura del depsito
trmico fro sea cero absoluto, lo que en la
prctica es imposible. Para cualquier otra
temperatura de
, parte del calor
suministrado a la mquina deber ser
transferido al sumidero trmico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
50
Mquinas y bombas trmicas
Es posible invertir la direccin del flujo de calor de una
mquina trmica, hacindola funcionar como bomba
trmica o refrigerador.
Para ello es necesario suministrar trabajo a la mquina
trmica y de esa forma bombeamos calor desde el
depsito a
hasta el depsito a
.
La expresin
=
denominada coeficiente de funcionamiento, nos indica la
mayor cantidad de calor que podemos remover para una
cantidad de trabajo determinada para esas temperaturas.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
51
Mquinas y bombas trmicas
Para una bomba de calor o refrigerador la
expresin
=
Indica la relacin entre el calor removida a la
temperatura ms baja y el trabajo empleado.
Para una mquina de Carnot
=
Indica el mximo valor de dados T
H
y T
C
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
52
Entropa de un gas ideal
La primera ley para un sistema cerrado es
=
Para un proceso reversible
=
=
=
Ecuacin general que relaciona las propiedades
de un sistema PVT cerrado aunque fue deducida
para procesos reversibles.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
53
Entropa de un gas ideal
Para un gas ideal
=
donde V es el volumen molar
=
=
=
Como
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
54
Entropa de un gas ideal
Tenemos que
=
Esta ecuacin nos indica que
= (, )
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
55
Entropa de un gas ideal
Integrando entre los estados 1 y 2, tenemos
=
1
+
1
Igualmente podemos encontrar la funcin de S
como S(T,P). De la ecuacin de estados ideales se
obtiene
+ =
dividiendo por PV y recordando que PV=RT
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
56
Entropa de un gas ideal
Reemplazamos dV en la ecuacin
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
57
Entropa de un gas ideal
=
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
58
OTRAS FUNCIONES DE ESTADO
Funcin de Gibbs y Funcin de Helmholtz
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
59
Funcin de Helmholtz
Se define la funcin de Helmholtz en la forma
siguiente:
=
Para un proceso reversible infinitesimal,
=
Y
=
=
De aqu
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
60
Funcin de Helmholtz
De esto deducimos:
Para un proceso isotrmico reversible
=.
=
1
La variacin de la funcin de Helmholtz
durante un proceso isotrmico reversible
corresponde al trabajo realizado sobre el
sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
61
Funcin de Helmholtz
Durante un proceso reversible, isotrmico e
isocrico,
= 0
Y
=
Estas propiedades son de inters en reacciones
que ocurren a presin y volumen constante
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
62
Funcin de Gibbs
Se define la funcin de Gibbs como
=
Para un proceso reversible infinitesimal
=
Y
= +
= +
luego
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
63
Funcin de Gibbs
Para un proceso isobrico, isotrmico y reversible
= 0
Y
=
Este es un resultado importante en procesos que
implican cambios de fase. Sublimacin, fusin y
evaporacin tienen lugar isoterma e isobricamente
y podemos suponer que ocurren en forma
reversible.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
64
Funcin de Gibbs
En esos procesos la funcin de Gibbs
permanece constante.
Si representamos las funciones molares de
Gibbs de un slido, un lquido y el vapor
saturado como G, G y G. Respectivamente,
la curva de fusin es
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
65
Funcin de Gibbs
La de la curva de vaporizacin ser
La de la curva de sublimacin
En el punto triple
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
66
Funcin de Gibbs
La mayora de las reacciones qumicas ocurren
a presin y temperatura constante, por lo que
la funcin de Gibbs tiene especial relevancia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
67
Fisicoqumica II
UNICIT
Propiedades de las Sustancias Puras
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
DIFERENCIALES EXACTAS E
INEXACTAS
Relaciones de las propiedades fundamentales
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Diferenciales exactas
Supongamos que tenemos una funcin
= (, ) diferenciable exactamente,
entonces su diferencial total estar dada por:
=
Por ejemplo, la expresin + es una
diferencial exacta ya que si = :
= +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Diferenciales exactas
Sin embargo la expresin y no es un
diferencial exacto, ya que no existe una funcin de x e y
cuyo diferencial total sea esa expresin.
Sin embargo podemos encontrar un factor de
integracin el que permitira transformar esta
expresin en un diferencial exacto.
La expresin
=
Es un diferencial exacto, donde
1
2
es el factor integrante.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Diferenciales exactas
Comparemos las expresiones
=
Y
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Diferenciales exactas
Para que sea exacta se debe dar que
=
1
=
1
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Diferenciales exactas
Dado que U es funcin de estado, su diferencial
total expresado en funcin de T y V para un
sistema PVT ser
=
Pero
= + =
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Diferenciales exactas
Y si esta expresin fuera un diferencial exacto
= + =
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Diferenciales exactas
En esta expresin se debiera dar que:
Pero por lo general:
0
Luego no es un diferencial exacto.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Diferenciales exactas
Introducendo el factor integrante
1
tenemos:
=
=
1
Pero dado que U es una funcin de estado
=
=
1
=
1
+
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
Diferenciales exactas
Dado que dS es un diferencial exacto se debe cumplir que
=
1
+
1
Esta ecuacin es una ecuacin estndar para sistemas
PVT de una fase.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
SISTEMAS PVT DE COMPOSICIN
VARIABLE
Potencial qumico
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Definicin de Potencial Qumico
Sistema PVT homogneo con
1
,
2
, ,
=
=
=
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Definicin de Potencial Qumico
Para el caso particular de un proceso reversible en que
todos los
son constantes:
=
=
Dado que la expresin es una diferencial exacta
,
=
,
=
El subndice adicional n indica que todos los n
i
elementos se
mantienen constantes.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Definicin de Potencial Qumico
Para el caso general
=
,
+
,
+
,,
=1
Donde el subndice
significa que todos los nmeros
molares son constantes a excepcin de
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Definicin de Potencial Qumico
Definiendo la funcin potencial qumico como
,,
Tenemos
= +
=1
Esta ecuacin es la relacin de propiedades
fundamentales de un sistema PVT homogneo de
composicin variable y es la base de todas las
propiedades deducidas para tales sistemas.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Definicin de Potencial Qumico
El sistema puede ser abierto o cerrado
Pueden ocurrir cambio de composicin por
Reacciones qumicas
Transporte de materia
Ambos
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
Otras funciones de estado
De igual forma podemos definir la entalpa y
las funciones de Helmholtz y de Gibbs
= +
=
= +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Otras funciones de estado
Al tomar diferenciales totales de esas funciones y
eliminando con la ecuacin anterior tenemos
= + +
=1
= +
=1
= + +
=1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Otras funciones de estado
Del hecho que se trata de diferenciales exactas se
deduce:
=
,
=
,
=
,
=
,
=
,
=
,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Otras funciones de estado
Tambin se deduce:
=
,
=
,,
,,
,,
,,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
REGLA DE LAS FASES
Sistemas sin reaccin qumica
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Regla de las fases
Sea m el nmero de especies qumicas de un
sistema.
Fracciones molares independientes para cada
fase =(m-1)
Las fracciones molares deben sumar uno.
Para fases, hay un total de (m-1)* variables de
composicin.
Adicionalmente, la temperatura y presin, que se
asumen homogneas en el sistema, son variables
de la regla de las fases.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
Regla de las fases
Total de variables independientes:
2 + 1 = 2 +
Ecuaciones independientes de equilibrio de fases
para cada especie = (-1)
Nmero de especies = m especies
Total de ecuaciones
1 =
Los grados de libertad corresponden al nmero
de variables independientes menos el nmero de
ecuaciones independientes
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Regla de las fases
Ecuaciones que las relacionan.
Si el nmero de variables es igual al nmero de
ecuaciones, el sistema est completamente
definido.
Si el nmero de variables es mayor que el nmero
de ecuaciones, la diferencia corresponde a los
grados de libertad. En otras palabras, el nmero
de variables independientes que debemos
especificar para que el sistema quede definido.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Regla de las fases
Si, por ltimo, el nmero de variables es
menor que el nmero de ecuaciones, nuestro
sistema est sobre definido y no tiene
solucin.
Regla de las Fases
= 2 + 1 1
= 2 +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
Ejemplo 1
Cuntos grados de libertad hay en un sistema
PVT conformado por una fase de vapor en
equilibrio con una fase lquida y que contiene:
Un nico componente
Dos especies qumicas que no reaccionan?
La regla de las fases para sistemas no reactivos
es:
= 2 +
Donde F es el nmero de grados de libertad, el
nmero de fases y m el nmero de componentes
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
Ejemplo 1
Caso a) =2 y m=1
= 2 +
Entonces
= 2 2 +1 = 1
Al fijar el valor de una variable el sistema est definido.
Caso b) =2 y m=2
Entonces
= 2 2 +2 = 2
Esto implica que al especificar dos variables intensivas
cualquiera, por ejemplo P y T queda completamente
especificado el sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
Ejemplo 2
La Ley de Charles establece que a bajas
presiones el volumen de un gas es
directamente proporcional a la temperatura
cuando la presin se mantiene constante. La
Ley de Boyle establece que a bajas presiones
la presin de un gas es inversamente
proporcional al volumen cuando la
temperatura se mantiene constante. Deducir
la Ley del Gas Ideal de estas dos
observaciones.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
29
Ejemplo 2
Segn la Ley de Charles,
=
1
=
Segn la Ley de Boyle
=
2
=
2
=
2
2
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Ejemplo 2
Para un sistema PVT de composicin contante
=
= +
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Ejemplo 3
Demuestre que el nmero mximo de fases en
equilibrio para un sistema PVT de un
componente es 3
= 2 +
= 2 +1 = 3
El nmero mnimo de grados de libertad es 0,
por lo que el nmero mximo de fases en
equilibrio posible es 3, que corresponde al
punto triple.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
Ejemplo 4
La entalpa se relaciona con la funcin de
Gibbs mediante la ecuacin de Gibbs-
Helmholtz.
Demostrar que
=
=
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
Ejemplo 4
Por definicin
= +
= + =
De la ecuacin
= + +
=1
Tenemos que
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
Ejemplo 4
Luego
= +
Y
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
35
Ejemplo 4
De la expresin
=
1
2
1
2
=
1
2
=
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Ejemplo 4
= +
=
= +
=
=
=
= +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
Ecuacin Fundamental
de la Termodinmica
Qumica
Ecuacin Fundamental
de la Termodinmica
Qumica
Ecuacin Fundamental
de la Termodinmica
Ejemplo 4
= +
=
= +
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Ejemplo 4
2
=
2
1
2
=
1
2
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
COMPORTAMIENTO PVT DE UNA
SUSTANCIA PURA
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Diagrama de superficies PVT
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Fisicoqumica II
UNICIT
Equilibrio de Fases en sistemas PVT
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
COMPORTAMIENTO PVT DE UNA
SUSTANCIA PURA
Diagramas PVT y otros diagramas
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Diagrama de superficies PVT
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Diagrama PT
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Diagrama PV
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Diagrama Entalpa Presin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Diagrama Entropa Presin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
EQUILIBRIO EN SISTEMAS
CERRADOS
Sistemas heterogneos
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Equilibrio en sistemas cerrados
Consideremos la aproximacin al equilibrio de
sistemas heterogneos que no estn
inicialmente en equilibrio respecto de la
distribucin de las diferentes especies
qumicas entre las fases coexistentes pero
separadas.
El sistema ms simple es el sistema a P y T
uniforme pero no necesariamente constante.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Equilibrio en sistemas cerrados
Consideremos adicionalmente que:
El sistema intercambia calor reversiblemente con el
entorno.
Los cambios de volumen del sistema ocurren de tal forma
que el trabajo intercambiado con el ambiente es
reversible.
El proceso considerado resulta del cambio en el
sistema desde un estado de desequilibrio hacia un
estado de equilibrio respecto de la distribucin de las
especies entre las fases.
Una propiedad total del sistema la denotaremos por el
superndice t.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
Equilibrio en sistemas cerrados
Para un intercambio reversible de calor Q, el cambio
de entropa del ambiente es:
El signo menos porque se refiere al sistema y la
temperatura T es la del sistema y del ambiente dado que el
intercambio es reversible.
La segunda ley exige
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
Equilibrio en sistemas cerrados
Dado que hemos asumido que reversibilidad
en la transferencia de calor y que el trabajo
tambin se efecta reversiblemente, la
desigualdad proviene de la transferencia de
masa entre las fases en el proceso de alcanzar
el equilibrio. La igualdad aplica cuando el
equilibrio de fases se ha alcanzado por el
sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Equilibrio en sistemas cerrados
Para un sistema cerrado:
=
Dado que el trabajo es reversible
=
Luego
=
Dado que
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Equilibrio en sistemas cerrados
Al restar una de otra las ecuaciones para Q:
0
0
Esta relacin involucra solamente propiedades
de estado y debe ser satisfecha por cualquier
sistema PVT cerrado, independientemente de
las suposiciones de reversibilidad hechas en su
deduccin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Equilibrio en sistemas cerrados
Para un proceso a entropa constante y
volumen constante
,
0
Si el proceso ocurre a
constantes
,
0
A partir de las definiciones de entropa,
funcin de Helmholtz y funcin de Gibbs
podemos llegar a expresiones similares.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Equilibrio en sistemas cerrados
Por ejemplo
,
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Equilibrio en sistemas cerrados
Consideremos la expresin
,
0
Esta indica:
Todos los procesos irreversibles que ocurren a P y T
constantes proceden en la direccin de la disminucin
de la funcin de Gibbs.
El estado de equilibrio, entonces, est dado por el
valor mnimo alcanzable por la funcin de Gibbs. Esto
significa que cualquier variacin diferencial de P y T no
alteran el valor de G
t
.
,
= 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
Equilibrio en sistemas cerrados
Este mismo razonamiento se ocupa para las
expresiones para energa interna, entalpa,
entropa y funcin de Helmholtz. Sin embargo
la funcin de Gibbs es preferida ya que es ms
simple tratar con las variables intensivas P y T
que con las otras funciones de estado.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Equilibrio en sistemas cerrados
La utilidad de este criterio es la razn principal
para introducir el potencial qumico como una
propiedad termodinmica. Su uso para el
clculo numrico de composiciones de
equilibrio depende de disponer de mtodos
cuantitativos para la descripcin de las
propiedades termodinmicas de las
soluciones.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Equilibrio de fases
Notemos que:
=
Donde
es el nmero de moles de la fase p y
es la funcin molar de Gibbs de la fase p. Su
diferenciacin nos da:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Equilibrio de fases
Esta ecuacin aplicada a la fase p a presin y
temperatura constantes nos da:
,
=
=1
Donde la sumatoria es sobre las m especies presentes.
Al combinar:
,
=
=1
=
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
REGLA DE LAS FASES GENERAL
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Regla de las fases
La regla de las fases para un sistema
multicomponente sin reaccin qumica es
= 2 +
Donde
F= grados de libertad del sistema
= nmero de fases del sistema
m= nmero de componentes del sistema
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
Regla de las fases
Si consideramos que hay reacciones qumicas, por
cada reaccin qumica aparece la condicin de
equilibrio:
= 0
En la que
son los potenciales qumicos y
coeficientes estequiomtricos de las especies
reaccionantes. Cada reaccin qumica independiente
proporciona una relacin entre potenciales qumicos
que reducen los grados de libertad.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Regla de las fases
Si tenemos r reacciones independientes:
= 2 +
Al decir reacciones qumicas independientes
indicamos que ninguna puede escribirse como
una combinacin de las dems.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Regla de las fases
Adicionalmente podemos tener restricciones
adicionales de estequiometra o electro
neutralidad. Asumiendo que existen
condiciones de este tipo la regla de las fases
queda
= 2 +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
Ejemplo 1
Para una disolucin acuosa del cido dbil
HCN escriba las condiciones de equilibrio
qumico y calcule los grados de libertad.
El nmero de especies qumicas son el agua, el
cido cianhdrico ms sus formas disociadas.
2
+
+
+
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
Ejemplo 1
Las reacciones qumicas
2
+
+
+
+
Dan las condiciones de equilibrio
+ +
+ +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
Ejemplo 1
Las especies presentes son:
Total: cinco especies
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
29
Ejemplo 1
Las condicin de electroneutralidad exige que
la cantidad carga positiva sea igual a la de
carga negativa.
+ =
El nmero de fases es uno.
Entonces
= 2 1 +5 2 1 = 3
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Ejemplo 2
Calcular los grados de libertad de un sistema
que consiste en
3
,
y
2
,
cuando todo el
y
2
provienen de
la reaccin:
3
+
2
Una fase constituye una porcin homognea del
sistema, por lo que tenemos dos fases slidas y
una gaseosa; es decir = 3.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Ejemplo 2
La condicin de equilibrio qumico indica que
3
+
2
3
=
2
La relacin estequiomtrica
2
No tiene influencia ya que no podemos derivar las
fracciones molares de ellas.
Tampoco tenemos restricciones de carga elctrica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
Ejemplo 2
Luego tenemos:
= 2 +
=3
m=3
r=1
a=0
= 2 3 +3 1 0 = 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
Ejemplo 3
Calcule F para una mezcla en fase gaseosa de
O
2
, O, O
+
y e
-
, donde todo el O procede de la
disociacin del O
2
, mientras que O
+
y e
-
proceden de la ionizacin del O. Indique la
eleccin ms razonable de las variables
intensivas independientes, (Respuesta: 2; T y
P.)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
Ejemplo 3
La regla de las fases nos dice:
= 2 +
Nmero de fases:
= 1 (solo fase gaseosa)
Las reacciones qumicas
2
2
+
+
Dan las condiciones de equilibrio
2
= 2
+ +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
35
Ejemplo 3
Los componentes presentes son cuatro:
2
; ;
+
,
La condicin de electroneutralidad nos pide
que:
+ =
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Ejemplo 3
Luego tenemos:
= 2 +
=1
m=4
r=2
a=1
= 2 1 +4 2 1 = 2
Las variables ms convenientes son P y T.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
REGLA DE TROUTON
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Regla de Trouton
La Regla de Trouton establece que la entropa
de vaporizacin tiene un valor constante,
entre 85 y 88
, para varios tipos de
lquidos en su punto de ebullicin.
La entropa de vaporizacin es la entalpa de
vaporizacin dividida por la temperatura de
ebullicin.
Se denomina as en honor a Frederik Thomas
Trouton
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
Regla de Trouton
Matemticamente se escribe:
= 10.5
Donde R es la constante universal de los gases-
Esta regla es vlida para muchos lquidos, por ejemplo
= 87.30
= 89.45
= 87.92
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Regla de Trouton
Esta regla no es til para lquidos altamente
polares y que generan enlaces de puente de
hidrgeno, por ejemplo: agua, etanol y cido
frmico.
La entropa del agua y del etanol muestran una
desviacin positiva del valor predicho debido a la
formacin de enlaces de puente de hidrgeno en la
fase lquida que hace disminuir la entropa en esa
fase.
La entropa de vaporizacin del cido frmico tiene
una desviacin negativa debido a la formacin de una
estructura ordenada en fase gaseosa.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Regla de Trouton
La validez de la regla de Trouton puede
mejorarse usando la expresin:
= 4.5 +
Conocida como regla de Trouton-Hildebrand-
Everett
Si T=400K tenemos
= 4.5 + 400 = 10.5
Que es la expresin original.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
42
Entalpias y entropas de fusin y
vaporizacin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
43
Sustancia
Tfusin
(K)
Hfusin
(kJ/mol)
Sfusin
(kJ/molK)
Tebullicin
(K)
Hebullicin
(kJ/mol)
Sebullicin
(kJ/molK)
Sebullicin
THE
(kJ/molK)
Ne 24.50 0.34 13.60 27.10 1.76 65.00 64.80
N
2
63.30 0.72 11.40 77.40 5.58 72.10 73.60
Ar 83.80 1.21 14.40 87.30 6.53 74.80 74.60
C
2
H
6
89.90 2.86 31.80 184.50 14.71 79.70 80.80
(C
2
H
5
)
2
0 156.90 7.27 46.40 307.70 26.70 86.80 85.10
NH, 195.40 5.65 28.90 239.70 23.30 97.40 83.00
CCl
4
250.00 2.47 9.90 349.70 30.00 85.80 86.10
H
2
O 273.20 6.01 22.00 373.10 40.66 109.00 86.70
I
2
386.80 15.50 40.10 457.50 41.80 91.40 88.30
Zn 693.00 7.38 10.70 1184.00 115.60 97.60 96.30
NaCl 1074.00 28.20 26.20 1738.00 171.00 98.40 99.40
ltima columna corresponde a valores segn regla de
Trouton-Hildebrand-Everett
Ejemplo 4
El punto de ebullicin normal del CS
2
es
319.4K. Estime los valores de
del
CS
2
a la temperatura de ebullicin normal
utilizando:
(a) la regla de Trouton
(b) la regla de Trouton-Hildebrand-Everett.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
44
Ejemplo 4
Usando la regla de Trouton:
= 1.987
= 8.314472
= 10.5 = 10.5 8.314472
= 87.30
= 87.30 319.4 = 27884
Usando la regla de Trouton-Hildebrand-Everett.
= 4.5 +
= 4.5 + = 4.5 + =
8.314472 4.5 + 319.4 = 85.36
= 85.36 319.4 = 27884
= 27264
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
45
CAMBIO DE FASES EN SUSTANCIAS
PURAS: ECUACIN DE CLAPEYRON
Ecuacin de Clapeyron y su simplificacin la de Clausius Clapeyron
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
46
Cambio de fases en sustancias puras:
Ecuacin de Clapeyron
Un cambio de fases representa la transicin entre dos
fases que coexisten en equilibrio, por lo que aplica:
,
= 0
Esto implica que la funcin de Gibbs del sistema cerrado donde
ocurre la transicin debe ser constante. Esto ocurre si la funcin
molar de Gibbs es la misma para ambas fases.
Para dos fases coexistentes, y , de una sustancia pura
Para un mol de material puro y homogneo
= +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
47
Cambio de fases en sustancias puras:
Ecuacin de Clapeyron
Reemplazando G obtenemos
Dado que el cambio de fases ocurre a la presin
de saturacin podemos decir =
y
modificando la forma en que presentamos
por
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
48
Cambio de fases en sustancias puras:
Ecuacin de Clapeyron
Podemos escribir
Una transicin de fases que ocurre a P y T
constantes requiere de un intercambio de calor
entre la sustancia tomada como sistema y el
medio que la rodea. Cuando la transicin se
realza reversiblemente este calor se denomina
calor latente y es igual al cambio de entalpa.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
49
Cambio de fases en sustancias puras:
Ecuacin de Clapeyron
Luego
=
Para un proceso reversible a temperatura
constante
Entonces
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
50
Cambio de fases en sustancias puras:
Ecuacin de Clapeyron
Llegamos entonces a la Ecuacin de Clapeyron
Indicando las fases slidas, lquidas y vapor por las letras s,
l y v, tenemos
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
51
Presiones de vapor y calores latentes
La ecuacin de Clapeyron nos da una conexin vital
entre las propiedades de diferentes fases. Se aplica
usualmente al clculos de entalpas de cambios de fase
para vaporizacin y sublimacin a partir de datos
volumtricos y de presin de vapor.
Es necesaria una buena correlacin entre presiones de
vapor y temperatura. Una grfica de ln(P
sat
) versus
1/T da una lnea casi recta sugiriendo una relacin del
tipo:
Donde A y B son constantes.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
52
Presiones de vapor y calores latentes
La ecuacin de Antoine es ms satisfactoria y
encuentra un amplio uso:
=
+
A, B y C son constantes
Hay otras ecuaciones que son an ms fieles y
representan extensivamente los datos.
Las relaciones son empricas. La termodinmica
no provee un modelo para el comportamiento de
la materia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
53
Ecuacin de Clausius-Clapeyron
Para los procesos de vaporizacin y sublimacin a baja
presin, podemos asumir que el vapor se comporta como un
gas ideal y que el volumen de la fase vapor es mucho ms
grande que el de la otra fase.
Para la vaporizacin tendremos
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
54
Ecuacin de Clausius-Clapeyron
1
=
A presiones muy inferiores a la presin crtica,
.
Luego podemos integrar entre
0
,
0
y , para obtener:
0
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
55
Ejemplo 5
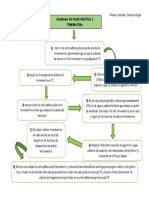
La presin de vapor del ter etlico, dada en
las International Critical Tables, es de 185
mmHg a 0C. El calor latente de vaporizacin a
0C es 92.5 cal/g. Calcular la presin de vapor
a 20C y 35C.
El ter etlico tiene la frmula:
5 2
Peso molecular: 74.12 kg/kg-mol
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
56
Ejemplo 5
La ecuacin de Clausius Clapeyron es:
0
1
Datos
= 185 1.3332 10
2
= 24464.2
0
= 0 = 273.15
= 92.5
4.1840
1000
= 387020
= 387.02
74.12
= 28686
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
57
Ejemplo 5
= 8.31434
Podemos escribir:
=
0
= 24464.2
28686
8.31434
1
273.15
20
= 24464.2
28686
8.31434
1
273.15
1
293.15
= 57914
35
= 24464.2
28686
8.31434
1
273.15
1
308.15
= 102705
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
58
Ejemplo 6
Encuentre la entalpa de vaporizacin del
alcohol metlico en el rango de temperaturas
21C-50C si las presiones de vapor son
100mmHg a 21C y 400mmHg a 50C.
Datos
Alcohol metlico:
4
Peso molecular: 32.04
= 8.31434
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
59
Ejemplo 6
Para T=21C=294.15K
21
= 100 1.3332 10
2
= 1,3332 10
4
Para T=50C=323.15K
50
= 400 1.3332 10
2
= 5,3328 10
4
La ecuacin de Clausius Clapeyron es:
0
1
5.3328 10
4
1.3332 10
4
=
8.31434
1
294.15
1
323.15
= 37765
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
60
Ejemplo 7
En base a los resultados del Ejemplo 6, cul sera
el punto de ebullicin normal del alcohol
metlico?
La temperatura de ebullicin normal ser la
temperatura a la que la presin de saturacin sea
760mmHg.
En el ejemplo anterior tenemos dos pares de
datos:
T=21C, P=100 mmHg
T=50C, P=400 mmHg
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
61
Ejemplo 7
Si tomamos el primer par de datos:
760
100
=
37765
8.31434
1
293.15
2.02815 = 4542.15 3.4112 10
3
1
= 3.4112 10
3
4.4618 10
4
= 2.9647 10
3
= 337.3
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
62
Ejemplo 7
Si tomamos el segundo par de datos:
ln
760
400
=
37765
8.31434
1
323.15
1
T
0.64185 = 4542.15 3.09454 10
3
1
T
1
T
= 3.09454 10
3
1.413106 10
4
= 2.9532 10
3
T = 338.6K
El punto de ebullicin normal es 64.7C=337.85K
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
63
Ejemplo 8
El punto de ebullicin normal del etanol es 78.3 C, y a
esta temperatura
= 38,9 kJ/gmol. Hasta qu valor
es necesario reducir P si queremos que el etanol hierva
a 25.0 C en una destilacin a presin reducida?
Datos
0
= 760
0
= 78.3 = 351.45
2
= 25 = 298.15
= 38.9
= 8.31434
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
64
Ejemplo 8
La ecuacin de Clausius Clapeyron es:
0
1
760
=
38900
8.31434
1
351.45
1
298.15
760
= 2.379856
= 760 0.09256 = 70.3
La presin de vapor experimental de etanol a 25C es 59mmHg.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
65
Equilibrio Slido Lquido
La ecuacin de Clausius-Clapeyron no tiene
validez en una transicin slido-lquido.
Durante la fusin la ecuacin de Clapeyron es:
Multiplicando por dT e integrando
=
2
1
2
1
=
2
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
66
Equilibrio Slido Lquido
El efecto de la presin sobre las propiedades de
lquidos o slidos es pequeo a menos que se
trate de presiones muy grandes, por lo que
podemos asumir que
no
cambian con la presin.
Luego
2
1
=
ln
2
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
67
Ejemplo 9
Calcule el punto de fusin del hielo a 100
atmsferas con los siguientes datos:
Calor latente de fusin del agua 79,7cal/g en el
punto normal de fusin
= 0,917 g/cm3 para el hielo a 0C y 1 atm
= 1,000 g/cm3 para el agua a 1 atm y 0C
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
68
Ejemplo 10
En el punto de fusin normal del NaCl, 801C,
su entalpa de fusin vale 28.8 kJ/mol, la
densidad del slido es 2,165 g/cm
3
y la
densidad del lquido es 1,733 g/cm
3
. Qu
aumento de presin se necesita para elevar
1,00 C su punto de fusin?
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
69
Fisicoqumica II
UNICIT
Disoluciones
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
COMPOSICIN DE LAS
DISOLUCIONES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Fraccin molar
Si un sistema contiene n
moles de la especie
qumica i y n
tot
es el nmero total de moles de
todas las especies presentes, se define la
fraccin molar x
de la especie i como:
= 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Concentracin molar
La concentracin molar c
i
de una especie i en
una disolucin de volumen V como;
En disoluciones lquidas, la concentracin molar
expresada en moles por litro (dm
3
), se denomina
molaridad.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Concentracin msica
La concentracin msica
i
de una especie i
en una disolucin de volumen V es
Donde m
i
es la masa de la especie i presente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Disolvente
En las disoluciones lquidas y slidas, suele
resultar conveniente considerar una sustancia
(denominada disolvente) de forma diferente a
todas las dems (denominadas solutos).
Normalmente, la fraccin molar del disolvente
es mayor que la fraccin molar de cada soluto.
Adoptaremos el convenio de designar al
disolvente mediante la letra A.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Molalidad
Se define la molalidad m
i
de la especie i en una
disolucin como el nmero de moles de i dividido por
la masa del disolvente. Sea una disolucin que
contiene n
B
moles de soluto B (ms cantidades
arbitrarias de otros solutos) y n
A
moles de disolvente A.
Sea M
A
la masa molecular del disolvente. La masa de
disolvente w
A
es igual a n
A
M
A
. Utilizamos el smbolo w
para la masa para evitar confusiones con la molalidad.
La molalidad m
B
del soluto es
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Porcentaje en peso
El porcentaje en peso de una especie B en
disolucin es (w
B
/w) x 100%, siendo w
B
la
masa de B y w la masa de disolucin. La
fraccin en peso de B es w
B
/w.
Como el volumen V de una disolucin
depende de T y P, las concentraciones c
y
i
cambian cuando lo hacen T y P. Las fracciones
molares y las molalidades son independientes
de T y P.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Ejemplo 1
Una disolucin acuosa de AgNO3 con una
composicin del 12,000% en peso de AgNO3
tiene una densidad de 1,1080 g/cm3 a 20 C y
1 atm. Calcule la fraccin molar, la
concentracin molar a 20 C y 1 atm, y la
molalidad del soluto AgN03.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Ejemplo 2
Se prepara una disolucin disolviendo 555,5 g
de sacarosa, C
12
H
22
O
11
, en 600 mL de agua, y
diluyendo con agua hasta un volumen final de
1.0000 L. La densidad de la disolucin final es
1.2079 g/cm3. Calcule la fraccin molar, la
molalidad y el porcentaje en peso de la
sacarosa en esta disolucin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
MAGNITUDES MOLARES PARCIALES
Volumen molar parcial
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
Volumen molar parcial
Asumamos que agregamos 1 gmol de agua
pura a un gran volumen de agua pura a 25C.
Si medimos el incremento en volumen
existente encontraremos que es de 18cm
3
, lo
que significa que el volumen molar del agua
es 18cm
3
/gmol.
Si agregamos un gmol de agua a un gran
volumen de etanol, el incremento ser de
14cm
3
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Volumen molar parcial
La diferencia en el aumento de volumen
observado se debe a:
Las diferencias entre las fuerzas intermoleculares
existentes en la disolucin y las existentes en los
componentes puros
Las diferencias entre el empaquetamiento de las
molculas en la disolucin y su empaquetamiento
en los componentes puros, debido a los distintos
tamaos y formas de las molculas que se
mezclan.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Volumen molar parcial
Al agregar 1 gmol de agua al gran volumen de
etanol, el empaquetamiento de las molculas de
agua entre las de etanol se traduce en que el
aumento de volumen sea solo 14cm
3
. El volumen
molar parcial en etanol puro es 14 cm
3
/gmol.
En general el volumen parcial de una sustancia i
en una mezcla, es el cambio de volumen por mol
de i agregado a un gran volumen de mezcla.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Volumen molar parcial
El volumen V de una disolucin es una funcin del estado de la disolucin,
que puede especificarse por medio de las variables T, P, n
1
, n
2
, ..., n
r
. Por lo
tanto,
= , ,
1
,
2
,
Definimos el volumen molar parcial
de la sustancia j como:
,,
Y su diferencial total ser:
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Volumen de la disolucin y
volmenes molares parciales.
El volumen V de una solucin depende de la
temperatura, la presin y los nmeros de
moles.
= , ,
1
,
2
,
Para T, P y fracciones molares, xi, constantes,
el volumen de la disolucin es proporcional al
nmero total de moles:
= , ,
1
,
2
, , ,
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Volumen de la disolucin y
volmenes molares parciales.
En la ecuacin anterior
Luego dV ser:
= , ,
1
,
2
, , ,
.
A T y P constantes,
=
Se transforma en
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
Volumen de la disolucin y
volmenes molares parciales.
Por definicin de fraccin molar:
Luego:
Como los x
i
son constantes,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Volumen de la disolucin y
volmenes molares parciales.
La ecuacin
=
Se transforma en:
=
Para T, P y x
i
constantes:
=
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Volumen de la disolucin y
volmenes molares parciales.
El cambio de volumen producido al mezclar
los componentes puros para formar la
disolucin a T y P constantes viene dado por:
Donde
es el volumen molar del
componente puro y mez se refiere al
proceso de mezclar.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Medida de volmenes molares
parciales.
Sea una disolucin formada por las sustancias A y B. Para medir
,,
se preparan disoluciones a la T y P deseadas; todas ellas
contendrn un nmero fijo de moles de A pero valores diferentes de n
B
. A
continuacin se representan los volmenes de disolucin medidos V
frente a n
B
. La pendiente de la curva de V frente a n
B
a cualquier
composicin ser entonces
para esa composicin. La pendiente de una
curva en cualquiera de sus puntos se determina dibujando la recta
tangente a la curva en ese punto y calculando su pendiente. Otra
posibilidad es expresar V como una funcin (por ejemplo un polinomio) de
n
B
y calcular la derivada de V respecto de n
B
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
Medida de volmenes molares
parciales.
Una frmula de ajuste polinmico a las mediciones del volumen de
una mezcla de agua/etanol a 25C que contiene 1.000 kg de agua
es:
= 1002.93 +54.6664 0.36394
2
+0.028256
3
Donde v es V/cm
3
, x=n
E
/gmol, y n
E
la cantidad de etanol
presente, por lo tanto el volumen parcial molar del etanol, V
E
,es:
,,
= 54.6664 0.72788 +0.084768
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Medida de volmenes molares
parciales.
Los volmenes molares son
siempre positivos, sin
embargo los volmenes
molares parciales pueden
ser negativos. Por ejemplo,
el volumen parcial mnimo
de MgSO
4
en agua es
-1.4cm
3
/mol. Al agregar 1
mol de MsSO
4
a un gran
volumen de agua el
volumen disminuye en
1.4cm
3
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
Volumen molar parcial del etanol
expresado por el polinomio.
Ejemplo 3
A 25C, la densidad de una solucin de
etanol/agua al 50% en masa es 0.914g/cm3. Si
el volumen molar parcial del agua en la
solucin es 17.4cm3/mol, Cul es el volumen
parcial del etanol?
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Ejemplo 4
Utilice la Figura para
calcular
en una disolucin de
MgS0
4
(ac), de molalidad
0,1 moles/kg, a 20 C y 1
atm.
Calcule
Para una solucin de 0.2
moles/kg a 20C y 1at.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Volumen molar parcial a disolucin
infinita.
Debido a las fuertes atracciones existentes entre los
iones del soluto y las molculas de agua, el volumen V
de la disolucin representado en la figura anterior
disminuye inicialmente al aumentar n
MgSo4
manteniendo n
H20
constante. La pendiente negativa
significa que el volumen molar parcial V
MgSO4
es
negativo para molalidades menores que 0,07 moles/kg.
El empaquetamiento abigarrado de las molculas de
agua en las capas de solvatacin alrededor de los iones
hace que el volumen de una disolucin diluida de M
gS04 sea menor que el volumen del agua pura
empleada para preparar la disolucin, con lo que V
MgSO
es negativo.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
Volumen molar parcial a disolucin
infinita.
El valor de V
en el lmite en el que la
concentracin de soluto i tiende a cero es el
volumen molar parcial de i a dilucin infinita,
y se simboliza por V
i
. Para calcular V
i
del M
gS04 en agua a 20 C, se dibuja en la figura la
recta tangente a la curva para n
MgSo4
= 0 y se
determina su pendiente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
Volumen molar parcial a disolucin
infinita.
Algunos valores de V
i
para solutos en
disolucin acuosa a 25 C y 1 atm,
comparados con los volmenes molares V
m,i
*
de los solutos puros, son:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
Soluto NaCl Na2SO4 MgSO4 H2SO4 CH3OH n-C3H7OH
V
i
(cm3/mol) 16.6 11.6 -7.0 14.1 38.7 70.7
V
m,i
*
(cm3/mol) 27.0 53.0 45.3 53.5 40.7 75.1
OTRAS MAGNITUDES MOLARES
PARCIALES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
29
Otras magnitudes molares parciales
El mismo desarrollo que se hizo para el
volumen, se puede hacer para cualquier
propiedad extensiva de una solucin.
Por ejemplo la energa interna U:
= , ,
1
,
2
,
,,
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Otras magnitudes molares parciales
De la misma forma, usando la misma
argumentacin llegamos a que:
=
Tambin tenemos
,,
,,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Otras magnitudes molares parciales
,,
,,
Siendo H, S, G y CP la entalpa, entropa, energa
de Gibbs y capacidad calorfica de la disolucin
respectivamente.
Todas las magnitudes molares parciales se
definen con T, P y n
ij
constantes.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
Relaciones entre propiedades molares
parciales
Para la mayora de las relaciones
termodinmicas entre propiedades extensivas
de un sistema homogneo, se pueden
encontrar las relaciones correspondientes en
las que se sustituyen las magnitudes
extensivas por magnitudes molares parciales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
Relaciones entre propiedades molares
parciales
Consideremos
=
Derivando parcialmente respecto de n
i
a T, P,
n
ji
constantes tenemos:
,,
,,
,,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
Relaciones entre propiedades molares
parciales
Otro ejemplo importante
=
Tomando la derivada respecto de n
i
,,
,,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
35
Relaciones entre propiedades molares
parciales
Resulta que
,,
De la misma manera derivando respecto de n
i
la expresin:
=
Llegamos a
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Resumen
El volumen molar parcial V
de un componente i en una
disolucin de volumen V se define como V
i
= (V/n
i
)
T,P,n
ji
. El
volumen de la disolucin viene dado por V = n
i
V
i
. Existen
ecuaciones semejantes para las dems propiedades extensivas
(U, H, S, G, etc). Se han encontrado relaciones entre G
i
, H
i
, S
i
y
V
i
; son similares a las relaciones correspondientes existentes
entre G, H, S y V. Se pueden obtener todas las propiedades
termodinmicas de una disolucin si se conocen los potenciales
qumicos
i
= G
i
en funcin de T, P y la composicin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
ECUACIN DE GIBBS-DUHEM
La variacin del potencial qumico de un componente de una mezcla no
es independiente del potencial qumico del resto de los componentes. En
una mezcla binaria al aumentar uno disminuye el otro.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Deduccin de la ecuacin de GD
Consideremos
=
Diferencindola
=
Igualando a:
= + +
+ = 0
= 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
Generalizacin de la ecuacin de GD
La ecuacin:
= 0
Puede generalizarse a cualquier magnitud molar parcial. Si Y es una
propiedad extensiva de una solucin:
= , ,
1
,
2
,
=
,,
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Generalizacin de la ecuacin de GD
=
Adems:
=
Diferenciando
=
Para P y T constantes dT=dP=0
Luego
= 0
= 0
, .
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Ejemplo 5
Los valores experimentales del volumen molar parcial de
K
2
SO
4
(ac) a 298K se expresan como
= 32.280 +18.216
1
2
Donde
4
/
3
y x es el valor numrico de
la molalidad = /
, donde
= 1 .
Escriba una ecuacin para el volumen molar marcial del agua
en la solucin utilizando la ecuacin de Gibbs-Duhem. El
volumen molar del agua es 18.079 cm3/gmol a 298K.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
42
Fisicoqumica II
UNICIT
Disoluciones Parte II
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
POTENCIAL QUMICO DE GASES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Potencial qumico de un gas ideal puro
Recordemos que para una cantidad fija de
sustancia:
=
Dividiendo por el nmero de moles del gas ideal
Para una sustancia =
, entonces a T cte.
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Potencial qumico de un gas ideal puro
Si el gas sufre una transformacin isoterma desde el
estado 1 al 2, tendremos
2
1
=
2
1
,
2
,
1
=
2
1
Haciendo P1 la presin estndar=1bar
, =
0
+
0
, 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Potencial qumico de un gas ideal puro
En un gas ideal puro
=
es slo funcin de T
Cuando P0,
, por
lo que -.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Potenciales qumicos de una mezcla de
gases ideales
Definiciones:
Una mezcla de gases ideales obedece a la ecuacin de
estado PV=n
tot
RT, donde n
tot
corresponde al nmero
total de moles de gas.
Si la mezcla se encuentra separada del gas puro i
(siendo i cualquiera de los componentes de la mezcla)
por una membrana rgida, diatrmica y permeable
solo al gas i, entonces en el equilibrio la presin
parcial del gas i,
del gas i en la mezcla es
igual a la presin del sistema constituido por el gas
puro.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Potenciales qumicos de una mezcla de
gases ideales
Sea
el potencial qumico
de i en la mezcla y
el de i
puro.
En equilibrio
En la mezcla:
, ,
1,
2
,
Gas puro:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Potenciales qumicos de una mezcla de
gases ideales
El potencial qumico de un gas puro i a la presin P
i
y la
temperatura T ser:
=
0
+
0
Para ,
0
1:
=
0
+
0
Esta ecuacin es la ecuacin termodinmica
fundamental para una mezcla de gases ideales.
El estado estndar corresponde a P=1bar a la T de la
mezcla.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Ejemplo 1
Utilice la expresin
=
0
+
0
para calcular G cuando 3,00 moles
de un gas ideal puro sufren un proceso
isotrmico en el que la presin se reduce
desde 2,00 bares a 1,00 bar a la temperatura
de 400 K.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
ENERGA DE GIBBS DE MEZCLA DE
GASES IDEALES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
10
Energa de mezcla
Consideremos dos gases ideales, en dos
recipientes, en cantidades n
A
y n
B
, ambos
estn a temperatura T y presin p.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
11
Energa de mezcla
Antes de mezclar los potenciales qumicos de los
gases puros a T y P son:
, =
0
+
, =
0
+
0
Luego de la mezcla
0
+
0
+
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
12
Energa de mezcla
El potencial qumico del sistema antes de mezclar
es:
0
+
0
+
0
+
0
El potencial qumico luego de la mezcla es:
0
+
0
+
0
+
0
Donde =
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
13
Energa de mezcla
Restando energa final menos energa inicial
Podemos reemplazar
Adems:
Luego
La fraccin molar es siempre <1, luego
<0.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
14
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
15
Un recipiente est dividido en dos compartimentos
iguales como en la figura. Uno contiene 3.0 moles de
H2 a 25C, el otro contiene 1.0 mol de N2 a 25C.
Calcule el G
mez
al eliminar la separacin. Asuma
comportamiento ideal.
3.0 moles H2
25C
1.0 moles N2
25C
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
16
Dado que los gases estn a diferentes
presiones debemos calcular por separado los
potenciales qumicos.
Los dos compartimentos son iguales, por lo
que segn la ley de gases ideales la presin en
el compartimento con H
2
es tres veces la
presin del compartimento con N
2
. Si P
H2
es
presin H
2
entonces P
H2
= 3*P
N2
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
17
2
=
2
0
+
2
=
2
0
+
3
2
=
2
0
+
= 3
2
0
+
3
0
+1
2
0
+
0
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
18
Al quitar la separacin los gases se mezclan y ocupan el
volumen total que es igual al doble del volumen inicial
del compartimento en que estaban.
Si un gas ideal ocupa el doble de volumen a T
constante su presin disminuye a la mitad. Por lo que
las presiones parciales en la mezcla sern:
2
=
2
2 = 3
2
2
2
=
2
2
2
+
2
= 3
2
2 +
2
2 = 2
2
Ejemplo 2
Las fracciones molares sern:
2
=
=
3
2
2
2
2
=
3
4
2
=
2
2
2
2
=
1
4
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
19
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
20
Por lo tanto la energa de Gibbs final es:
2
,
2
=
2
0
+
3
2
2
2
,
2
=
2
0
+
2
2
= 3
2
0
+
3
2
2
0
+1
2
0
+
2
2
0
Ejemplo 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
21
La diferencia entre G
final
y G
inicial
es:
= 3
2
0
+
3
2
2
0
+ 1
2
0
+
2
2
0
3
2
0
+
3
0
1
2
0
+
0
Los trminos correspondientes al potencial
qumico estndar se anulan en la diferencia y
la ecuacin quedar
Ejemplo 2
= 3 3
2
2 +
2
2
3 3
= 3
3
2
+3
2
+
2
2 3ln 3
3
2
= 3
3
6
2
= 8.31434 298.15 2.77 = 6873
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
22
Otras funciones termodinmicas de
mezcla
Recordemos que
,
=
)
Dado que ln(x)<0, entonces S
mez
>0 para cualquier
composicin.
La entalpa de mezcla isobrica isotrmica es
G +
= 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
23
CALOR INTEGRAL Y DIFERENCIAL DE
SOLUCIN
Levine.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
24
Calor integral de solucin
Definicin:
Para una disolucin con dos componentes, la
magnitud
mez
H/n
B
se denomina calor integral de
disolucin por mol de B en el disolvente A, y se
simboliza por H
intB
:
Numricamente
es igual al calor absorbido
por el sistema cuando 1 mol puro de B se aade a
la cantidad suficiente de A, a T y P constantes,
para obtener una solucin de concentracin x
B
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
25
Calor diferencial de solucin
Supongamos que agregamos un mol de B a un
volumen de solucin infinita de B en A de
composicin x
B
a P y T constantes. La
composicin de la disolucin permanecer
constante en el proceso. El cambio en entalpa
por mol de B aadido a P y T constantes a una
disolucin de composicin constante se
denomina calor diferencial de solucin de B
en A y se representa como H
dif B
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
26
POTENCIAL QUMICO DE LQUIDOS
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
27
Potencial qumico de lquidos
En el estudio de las propiedades de las
mezclas de lquidos en equilibrio, debemos
saber cmo vara la energa de Gibbs con la
composicin.
En el equilibrio, el potencial qumico de una
sustancia en estado gaseoso debe ser igual al
potencial qumico en estado lquido.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
28
SOLUCIONES IDEALES: LEY DE
RAOULT
Soluciones ideales
Notacin
,
.
La presin de vapor de un lquido puro A es
, su
potencial qumico tratado como gas ideal es
0
+
En el equilibrio los dos potenciales son iguales, por lo
que:
0
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
30
Soluciones ideales
Si hay otra sustancia presente, por ejemplo un
soluto, el potencial qumico de A se modifica a
y
su presin de vapor a
el vapor y el solvente estn
en equilibrio, por lo que
0
+
De la ecuacin anterior despejamos el potencial
estndar
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
31
Soluciones ideales
0
=
Y reemplazamos en la ecuacin anterior obteniendo
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
32
Soluciones ideales
Franois Raoult, en una serie de experimentos con
lquidos vinculados entre s (benceno +
metilbenceno) descubri que la relacin entre la
presin de vapor parcial de cada componente y su
presin de vapor como lquido puro es
aproximadamente igual a la fraccin molar de A en la
mezcla de lquidos:
Esta expresin se conoce como la ley de Raoult.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
33
Soluciones ideales
Esta ley la siguen bastante bien mezclas de
componentes similares. Una mezcla que sigue la ley
de Raoult desde A puro hasta B puro se denomina
solucin ideal.
Para una solucin ideal
Esta ecuacin define a una solucin ideal.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
34
SOLUCIONES DILUIDAS IDEALES: LEY
DE HENRY
Soluciones diluidas ideales
En una solucin ideal tanto el soluto como el
solvente cumplen con la Ley de Raoult.
En las soluciones reales a bajas
concentraciones, si bien la presin de vapor
del soluto es proporcional a la fraccin molar,
la constante de proporcionalidad no es la
presin de vapor de la sustancia pura. Esto lo
descubri el qumico ingles William Henry.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
36
Soluciones diluidas ideales
La Ley de Henry dice que:
es la fraccin molar y
es una constante
emprica (con dimensiones de presin) elegida
de modo que el grfico de la presin de vapor
de B en funcin de su fraccin molar sea
tangente a la curva experimental para
= 0.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
37
Soluciones diluidas ideales
Las mezclas en las que el soluto cumple la Ley
de Henry y el solvente la Ley de Raoult se
denominan soluciones diluidas ideales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
38
Ejemplo 3
Se midieron las presiones de vapor de cada
componente de una solucin de acetona, A, y
cloroformo, C, a 35C obteniendo los
siguientes resultados
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
39
x
C
0 0.20 0.40 0.60 0.80 1.00
P
C
kPa 0 4.7 11 18.9 26.7 36.4
P
A
kPA 46.3 33.3 23.3 12.3 4.9 0
y = 13.839x
2
+ 22.718x - 0.15
R = 0.9997
y = 22.723x
2
- 69.538x + 46.454
R = 0.9988
0
5
10
15
20
25
30
35
40
45
50
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
P
r
e
s
i
n
(
k
P
a
)
Fraccin molar de cloroformo
Determinacin constantes de Henry
PC kPa PA kPA
Recta A Recta C
Poly. (PC kPa) Poly. (PA kPA)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
40
Ejemplo 3
Del grfico las constantes determinadas son:
= 24.14
= 22.72
En el texto las constantes determinadas son:
= 23.3
= 22.0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
41
Ejemplo 3
La presin de vapor del clorometano a
distintas fracciones molares en una mezcla a
25C es la siguiente:
Estime la constante de Henry.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
42
x 0.005 0.009 0.019 0.024
p/kPa 27.3 48.4 101 126
La constante de Henry
En muchas ocasiones la constante de Henry se
expresa en base a la molalidad.
De esta forma la expresin queda:
Para algunos gases en agua a 25C la constante de Henry es:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
43
Gas K
B
/(kPa kg/mol)
CO
2
3.01x10
3
H
2
1.28x10
5
N
2
1.56x10
5
O
2
7.92x10
4
Ejemplo 4
Estime la solubilidad del oxgeno en agua a
nivel del mar y 25C.
Estime la solubilidad del nitrgeno en agua
expuesta al aire a 25C.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
44
Propiedades de las soluciones
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
45
MEZCLA IDEAL DE LQUIDOS
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
46
Mezcla ideal de lquidos: energa de
Gibbs
Energa de Gibbs antes de mezclar
Al mezclarse los lquidos los potenciales
qumicos estn dados por:
Energa de Gibbs despus de mezclar
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
47
Mezcla ideal de lquidos: energa de
Gibbs
La energa de Gibbs de mezcla ser:
Donde =
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
48
Mezcla ideal de lquidos: entropa y
entalpa
La entropa de mezcla ser:
,
=
,
=
La entalpa de mezcla est dada por:
= 0
Nos indica que la principal fuerza de mezcla es
el aumento de entropa y la entalpa es cero.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
49
MEZCLAS DE LQUIDOS: FUNCIONES DE
EXCESO Y SOLUCIONES REGULARES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
50
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
Para una propiedad termodinmica X, se
define la funcin de exceso como:
La entropa ser
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
51
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
La entalpa y el volumen de exceso son iguales
a la entalpa y volumen de mezcla observados
ya que los valores ideales son cero:
La desviacin de las funciones de exceso de
cero nos indican cuan alejado de la idealidad
es el comportamiento de la solucin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
52
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
En la figura se muestra
la entalpa de exceso
para la mezcla binaria
benceno_ciclohexano a
25C.
La mezcla es
endotrmica, ya que la
entalpa de mezcla de
solucin ideal es cero.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
53
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
El volumen de exceso para
la mezcla tetracloroeteno
ciclopentano
Este grfico muestra que
hay una contraccin a
bajas fracciones molares
de tetra cloro eteno pero
una expansin a altas
fracciones molares. Debido
a que el cambio de
volumen de mezcla es 0
para una solucin ideal.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
54
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
Soluciones regulares: Es una solucin en la que
= 0.
Podemos considerar una solucin regular como
una solucin en la que los diferentes tipos de
molculas se distribuyen aleatoriamente (tal
como en una solucin ideal) pero tienen
diferentes energas de interaccin entre ellas. El
modelo de solucin regular da cuenta de las
diferencias existentes entre esas interacciones.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
55
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
Para dar cuenta de ese concepto en forma
cuantitativa se asume que la entalpa depende
de la composicin:
Donde es un parmetro que da cuenta de
las de la relacin entre la energa de las
interacciones A-B y la energa de las
interacciones A-A y B-B.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
56
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
En la grfica se muestra el cambio
de H
E
para diferentes valores de
, si <0, el mezclado es
exotrmico y las interacciones
soluto solvente son ms
favorables que las interacciones
soluto-soluto y solvente-solvente.
Si >0, entonces el mezclado es
endotrmico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
57
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
En el caso de la entropa de exceso en
soluciones regulares tiene su valor ideal. La
energa de exceso de Gibbs es igual a la
entalpa de exceso, por lo que la energa de
mezclado de Gibbs est dada por:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
58
Mezclas de lquidos: Funciones de
exceso y soluciones regulares
En la figura se muestra la
con la composicin para distintos
valores de . Para >2, el grfico
muestra dos valores mnimos
separados por un valor mximo.
Esto implica que si >2, el sistema
se separa en forma espontnea
en dos fases cuya composicin
corresponde a una reduccin de
la energa de Gibbs.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
59
PROPIEDADES COLIGATIVAS
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
60
Definicin
Se llaman propiedades coligativas a aquellas
propiedades de una disolucin que dependen
nicamente de la concentracin, es decir, de la
cantidad de partculas de soluto por partculas
totales, y no de la composicin qumica del
soluto.
Disminucin de la presin de vapor
Elevacin del punto de ebullicin
Disminucin del punto de congelacin
Presin osmtica
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
61
Suposiciones
Suposiciones:
El soluto no es voltil, no est presente en la fase
vapor.
El soluto no se disuelve en el solvente slido.
Cuando la disolucin se congela el solvente puro
se separa.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
62
Fundamentos
Todas las propiedades coligativas provienen
de la disminucin del potencial qumico del
solvente lquido en presencia del soluto.
En una solucin ideal la disminucin es desde
. Dado que
< 1,
< 0. El soluto no influye el potencial
qumico del solvente en estado slido o
gaseoso pues no est presente en esos casos.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
63
Propiedades coligativas
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
64
Disminucin de la Presin de Vapor
Consideremos una solucin binaria de un
solvente A y un soluto B no voltil (usualmente
un slido).
La presin de vapor P de la solucin se debe casi
exclusivamente a la presencia de A.
Si la solucin es muy diluida llegamos a
=
Para un soluto nico que no se disocia
1 =
Disminucin de la Presin de Vapor
P es independiente de
la naturaleza del soluto
y solo depende de su
fraccin molar en
solucin.
En la figura se muestra
el comportamiento de
una solucin de azcar
en agua a 25C.
Ejemplo 5
La presin de vapor del agua a 110 C es
1074,6 torr. Calcule la presin de vapor a
110C de una disolucin al 2,00% en peso de
sacarosa (C
12
H
22
O
11
) en agua. Indique
cualquier aproximacin que haya utilizado.
Ejemplo 6
La presin de vapor de 500 g de benceno es
400 Torr a 60,6 C, pero cae a 386 Torr cuando
19,0 g de un compuesto orgnico no voltil
fue disuelto en 500 g de benceno. Calcule la
masa molar del compuesto.
Elevacin del punto de ebullicin
Nos interesa el equilibrio heterogneo entre el
solvente en estado gaseoso y el solvente en
solucin a 1 atm. Representamos el solvente
como A y el soluto como B. El equilibrio se
produce a una temperatura T tal que:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
69
Elevacin del punto de ebullicin
La ecuacin de Gibbs Helmholtz relaciona la
entalpa con la funcin de Gibbs.
=
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
70
Elevacin del punto de ebullicin
Luego
2
=
Entonces
2
=
Integrando desde
= 1
()
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
71
Elevacin del punto de ebullicin
= 1
Si
1 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
72
Elevacin del punto de ebullicin
2
El punto de ebullicin normal cambia con la fraccin
molar de soluto:
=
=
2
Donde K es la constante ebulloscpica de la sustancia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
73
Elevacin del punto de ebullicin
No depende de la naturaleza del soluto, slo de su
fraccin molar.
T depende del solvente.
Los mayores cambios se producen para solventes con puntos de
ebullicin elevados.
Considerando que la fraccin molar xB es
proporcional a la molalidad:
=
K
e
es la constante ebulloscpica emprica.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
74
Disminucin del punto de
congelamiento
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
75
Nos interesa el equilibrio heterogneo entre el
solvente slido puro y la solucin con un
soluto de fraccin molar x
B
. En el punto de
congelamiento los potenciales qumicos deA
en las dos fases son iguales.
La nica diferencia con el caso anterior es el
reemplazo de la fase gaseosa por la fase
lquida pura.
Disminucin del punto de
congelamiento
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
76
El desarrollo es similar. Por lo que podemos
escribir:
=
=
2
Bajas entalpas y elevadas temperaturas de
fusin tienden a aumentar la disminucin.
Disminucin del punto de
congelamiento
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
77
Si asumimos que la fraccin molar es
proporcional a la molalidad, vlido para
soluciones diludas, tenemos:
=
K
C
es la constante crioscpica emprica.
Disminucin del punto de
congelamiento
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
78
Algunos valores de constantes ebulloscpicas
y crioscpicas:
Sustancia K
c
(K/kg mol) K
e
(K/kg mol)
Benceno 5.12 2.53
Alcanfor 40.0
Fenol 7.27 3.04
Agua 1.86 0.51
Ejemplo 7
Aadimos 475g de sacarosa a 600g de agua.
Cuales sern los puntos de congelacin y
ebullicin de la solucin?
Calcule el punto de ebullicin y punto de
congelacin de una solucin que contiene
257g de naftaleno (C10H8) disueltos en 500g
de cloroformo (CHCl3)
Ejemplo 8
El punto de congelacin de una disolucin de
2,00 g de maltosa en 98,0 g de agua es -0.112C.
Estime el peso molecular de la maltosa.
Ejemplo 9
El punto de ebullicin del CHCl
3
es 61,7 C. En
una disolucin de 0,402 g de naftaleno (C
10
H
8
)
en 26,6 g de CHCl
3
, el punto de ebullicin
aumenta en 0,455 K. Calcule
vap
H
m
del CHCI
3
.
Ejemplo 10
Sea W el porcentaje en peso de maltosa en
una disolucin acuosa. Se observaron los
siguientes descensos del punto de congelacin
en disoluciones acuosas de maltosa:
W 3.0 6.0 9.0 12.0
T
f
(C) -0.169 -0.352 -0.55 -0.765
Ejemplo continuacin
(a) Demuestre que la ecuacin T
f
= - k
f
m
B
conduce a M
B
= -k
f
w
B
/(T
f
w
A
), donde w
B
y w
A
son las masas de B y de A en la disolucin. (b)
Represente los pesos moleculares calculados
frente a W y extrapole el resultado a
concentracin cero para obtener el peso
molecular verdadero.
Solubilidad
La solubilidad no es una propiedad coligativa
(cambia con la identidad del soluto), pero
podemos estimarla usando las mismas tcnicas.
En la saturacin el soluto no disuelto est en
equilibrio con el soluto disuelto.
Por lo tanto el potencial qumico del soluto puro
en estado slido,
, es igual al potencial de
soluto en solucin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
84
Solubilidad
Luego
Siguiendo un razonamiento similar al anterior
llegamos a:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
85
Solubilidad
Solubilidad disminuye
exponencialmente bajo el
punto de fusin.
Al aumentar T* y H
fus
,
La solubilidad es baja a
temperaturas normales.
No predice la diferente
solubilidad para
diferentes solventes. No
toma en cuenta las
propiedades del solvente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
86
Ejemplo 11
La entalpa de fusin del antraceno es 28,8 kJ
mol
-1
y su punto de fusin es 217 C. Calcule
su solubilidad ideal en benceno a 25 C.
Ejemplo 12
Prediga la solubilidad ideal del plomo en
bismuto a 280 C dado que su punto de fusin
es 327 C y su entalpa de fusin es 5,2 kJ/mol
smosis
Es el pasaje espontneo de un solvente puro
hacia una solucin separada de l por una
membrana permeable al solvente pero no al
soluto.
La presin osmtica es la presin que debe
aplicarse a la solucin para impedir la entrada de
solvente.
Ejemplos:
Transporte a travs de membrana celular
Dilisis
Osmometra (determinacin de masa molecular)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
89
smosis
En el equilibrio el potencial qumico del
solvente debe ser igual a ambos lados de la
membrana.
El soluto disminuye el potencial qumico del
solvente.
Al aplicar presin el potencial qumico del
solvente en solucin vuelve al valor del
potencial qumico del solvente puro.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
90
smosis
Ecuacin de vant Hoff:
=
Donde
es la concentracin molar del soluto B.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
91
smosis
En el compartimento del solvente puro el
potencial qumico es
En la solucin el potencial qumico es
+ =
+ +
+ +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
92
Parntesis Termodinmico
=
Si T=cte.
=
Integrando
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
93
smosis
Si
= +, entonces:
+ =
Luego
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
94
smosis
Para soluciones diluidas
= 1
Podemos asumir que para el intervalo de
presin el volumen molar permanece
constante, Vm=cte.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
95
smosis
Si adems asumimos que
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
96
Ejemplo 13
Calcule la presin osmtica a 25 C y 1 atm de
una disolucin de glucosa (C
6
H
12
O
6
) en agua de
molalidad 0,0100 mol/kg.
Solucin:
Asumimos comportamiento ideal
La densidad de la solucin es la del agua; 1.00kg/l y
asumimos que la concentracin molar de la glucosa es
0.01 moles/lt.
=
= 0.01
3
8.31434
298.15 = 24.79 = 186 .
Ejemplo14
A 25 C, una disolucin preparada disolviendo 82.7 mg
de un compuesto no electrlito en agua hasta alcanzar
un volumen de 100,0 ml tiene una presin de 83,2 torr.
Calcule el peso molecular del compuesto no electrlito.
Solucin: Aplicando la ecuacin de vant Hoff
=
= 83.2 = 11092
11092
2
=
8.31434
298.15
= 4.4746
3
Ejemplo 14
= 4.4746
=
82.7
100
1000
1000000
3
= 827
=
827
4.4746
= 185
Fisicoqumica II
UNICIT
Actividad
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
ACTIVIDAD DEL SOLVENTE
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del solvente
En una solucin ideal se cumple la Ley de
Raoult.
Si la solucin NO cumple la Ley de Raoult:
es la actividad de A, una especie de
fraccin molar efectiva.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del solvente
Componente Base Estado Estndar Actividad Lmites
Slido o Lquido Puro a=1
Solvente Raoult Solvente Puro
=
, =
1 1
(solvente puro)
Soluto Henry (1) Estado hipottico
de soluto puro
(2) Estado hipottico
de soluto a
molalidad b*
=
, =
=
1 0
1 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Estados Estndar
Actividad del solvente
Para medir la actividad del solvente se
determina experimentalmente midiendo la
presin de vapor.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 1
La presin de vapor de una solucin acuosa
0.500M de KNO
3
a 100C es 99.95kPa. Cul
es la actividad del agua a esa temperatura?
= 99.95
= 101.325kPa
=
99.95
101.325
= 0.9864
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad
Para los solventes es vlida la Ley de Raoult a medida que la
concentracin de soluto tiende a cero, la actividad del solvente se
aproxima a la fraccin molar a medida que x
A
1. Luego:
Se define el coeficiente de actividad
A
como:
1
Luego:
Estado estndar del solvente: solvente puro en estado lquido a 1
bar, se establece cuando x
A
=1
El coeficiente de actividad
i
mide el grado de divergencia del
comportamiento de la sustancia i respecto al comportamiento
diluido o diluido ideal.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
SOLUTOS IDEALES
Actividad del soluto
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
El coeficiente de actividad y el estado estndar
para el soluto se aproximan al
comportamiento de disolucin ideal diluida
(ley de Henry) cuando x
B
0 y no cuando
x
B
1 (soluto puro)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
Para las soluciones diluidas ideales (ley de
Henry):
Recordar
0
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
Luego:
0
+
0
=
Si la solucin es ideal,
, y
0
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
SOLUTOS REALES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
En las soluciones reales, que se desvan de la
solucin diluida ideal (ley de Henry), para el
soluto remplazamos
0
+
Definimos el coeficiente de actividad tal que:
Toda desviacin de la realidad se incluye en el
coeficiente de actividad.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
Luego
0
La eleccin de un estado estndar es arbitraria. En
qumica es de uso comn la molalidad,
, en
lugar de la fraccin molar. Por lo tanto:
0
+
0
es diferente a los valores estndares vistos
hasta ahora
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad del soluto
De acuerdo a esta definicin
cuando
= 1
Cuando la solucin se hace ms diluida, el soluto
se estabiliza ms.
0
Cualquier desviacin est incluida en .
=
0
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 2
Usando los datos del ejemplo 3 de la sesin 6
calcular la actividad y el coeficiente de
actividad del cloroformo en acetona a 25C
como solvente y luego como soluto.
Los datos son:
x
C
0 0.20 0.40 0.60 0.80 1.00
P
C
kPa 0 4.7 11 18.9 26.7 36.4
P
A
kPA 46.3 33.3 23.3 12.3 4.9 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 2
Para determinar la actividad del cloroformo
debemos elegir el estado estndar
correspondiente:
Para la situacin de solvente, la base es la Ley de
Raoult y el estado de referencia es el solvente
puro, por lo que
Para la situacin de soluto, la base es la ley de
Henry y el estado de referencia es el estado
hipottico de soluto puro, por lo que
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 2
La presin de vapor del cloroformo puro es
36.4kPa y K
C
lo determinamos en el ejercicio
anterior como 22.72 kPa
Usando esos valores generamos una tabla
x
C
0 0.2 0.4 0.6 0.8 1
a=P/P*c (Raoult) 0 0.13 0.3 0.52 0.73 1
a=p/Kc (Henry) 0 0.21 0.48 0.83 1.18 1.6
c= (Raoult) 0.65 0.76 0.87 0.92 1
c= (Henry) 1 1.04 1.21 1.39 1.47 1.6
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 2
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
1.8
0 0.2 0.4 0.6 0.8 1 1.2
A
c
t
i
v
i
d
a
d
,
y
c
o
e
f
i
c
i
e
n
t
e
d
e
a
c
t
i
v
i
d
a
d
,
Fraccin molar de cloroformo
Variacin de la actividad y el coeficiente de actividad de
Cloroformo y Acetona con la composicin.
a=P/P*c (Raoult)
a=p/Kc (Henry)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
SOLUCIONES REGULARES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad de soluciones regulares
Del modelo de solucin regular podemos
entender el origen de las desviaciones de la
ley de Raoult y su relacin con los coeficientes
de actividad.
Punto de partida:
De aqu se llega a las ecuaciones de Margules:
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad de soluciones regulares
Para el compuesto A tenemos:
2
=
1
Lo mismo se deduce para el compuesto B
Si
1, entonces
que toma la forma de la ley
de Henry si identificamos
, que es diferente para
cada sistema soluto-solvente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Actividad de soluciones regulares
En la figura se muestra la
presin de vapor de una
mezcla usando el modelo
donde el exceso de entalpa
es proporcional a
.
Para =0 se tiene la ley de
Raoult.
Para >0 la presin de
vapor es mayor que la ideal.
Para <0 la presin de
vapor es menor que la ideal.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
COEFICIENTES DE ACTIVIDAD DE
SOLUTOS NO VOLTILES
Levine
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Para un slido disuelto en un solvente lquido, la
presin parcial de vapor del soluto sobre la
solucin es muy difcil de medir por lo pequea
que es y no puede usarse para calcular el
coeficiente de actividad del soluto.
Midiendo la presin de vapor sobre la disolucin
en funcin de la disolucin obtenemos P
A
, la
presin parcial del disolvente lo que permite
calcular
A
. Usando la ecuacin de Gibbs-Duhem
podemos encontrar
B.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Ecuacin de Gibbs Duhem para una solucin binaria:
= 0 , .
= 0 , .
Anteriormente vimos:
, .
Similarmente
, .
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Sustituyendo d
A
y d
B
, obtenemos despus de
dividir por RT.
= 0
= 0
Como
= 1
= 0
= 0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Tomando el compuesto B como soluto y A como
el solvente, entonces para el estado de A puro, es
decir x
B
0,
B
1 y ln
B
=0.
Estado 1: Disolvente A puro
Estado 2: La concentracin de inters.
2
1
2
1
1
2
=
2
1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Pero
1
=0
2
=
2
1
El rea bajo la curva de
vs
entre
x
A
=1 y x
A2
es el valor de
2
.
El hecho que cuando x
A
tiende a 1
tiende
a hace complicada la evaluacin grfica de
la integral.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Solutos no voltiles
Coeficientes de actividad para disoluciones
acuosas de sacarosa a 25C calculados a partir
de presiones de vapor y usando la ecuacin de
Gibbs-Duhem:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
x (H
2
O) 0.999 0.995 0.980 0.960 0.930 0.900
H
(H
2
O) 1.0000 0.9999 0.998 0.990 0.968 0.939
H
(C
12
H
22
O
11
) 1.009 1.047 1.231 1.58 2.31 3.23
ACTIVIDAD DE IONES EN SOLUCIN
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad medio
Potencial qumico de un catin monovalente
M
+
se indica como
+.
Potencial qumico de un anin monovalente X
-
se indica como
-.
La energa molar de Gibbs de una solucin
elctricamente neutra es la suma de esas
cantidades parciales. Para una solucin ideal:
=
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad medio
Para una solucin real de M
+
y X
-
de igual
molalidad:
=
+
+
=
+
+
+
+
+
+
No hay modo experimental de separar el
producto
+
en las contribuciones
individuales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad medio
Para un electrolito 1:1 introducimos el coeficiente
de actividad medio como:
=
+
1
2
Y los potenciales qumicos individuales son:
+
=
+
La suma de estos potenciales es la misma que la
inicial pero la desviacin del comportamiento
ideal se comparte en partes iguales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad medio
Generalicemos para un compuesto M
p
X
q
que
se disuelve en una solucin de p cationes y q
aniones por cada unidad de frmula.
=
+
+
+
+
+
Introduciendo el coeficiente de actividad
medio:
=
+
1 +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Coeficiente de actividad medio
El potencial medio de cada in ser:
=
+
+
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ley lmite de Debye Hckel
Para concentraciones muy bajas, el coeficiente de actividad
se puede calcular a partir de la ley lmite de Debye-Hckel
=
+
1 2
En donde A=0.509 para una solucin acuosa a 25C e I es la
fuerza inica adimensional de la disolucin:
=
1
2
Para soluciones formadas por dos tipos de iones a
molalidades b
+
y b
-
:
=
1
2
+
+
2
+
2
/
0
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ley de lmite de Debye-Hkel
El trmino Ley Lmite se aplica a la expresin
anterior ya que las soluciones inicas de
molalidad moderada pueden tener
coeficientes de actividad diferentes de los
valores entregados por esa expresin, aunque
se espera que todas las soluciones se ajusten a
medida que b0. A molalidades bajas
(menores que 1mmol/kg) la Ley Lmite se
ajusta muy bien a la realidad. A valores ms
elevados se desva significativamente.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ley lmite de Debye-Hkel
Hay una desviacin
marcada para fuerzas
inicas moderadas, sin
embargo cuando I0
las pendientes
coinciden con la teora.
La ley se puede usar
para extrapolar datos a
molalidades muy bajas.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo
El coeficiente de actividad medio de KCl(ac)
5.0x10-3 mol/kg a 25C se calcula de la
siguiente forma:
=
1
2
+
+
0
=
0
Donde b es la molalidad de la solucin:
+
=
=
Luego el coeficiente de actividad medio es
= 1 1 0.509
1
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo
=
1
2
5 10
3
+5 10
3
1 = 5 10
3
= 1 1 0.509 5 10
3
1
2
= 0.036
= 0.92
El valor experimental es 0.927.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ley de Debye Hckel extendida
Cuando la fuerza inica es muy alta para que
se cumpla la ley lmite, el coeficiente de
actividad se puede estimar de la ley de Debye-
Hckel extendida:
=
+
1
2
+
1
2
+
En donde B y C son constantes
adimensionales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ley de Debye Hckel extendida
La Ley de Debye-Hckel
extendida coincide con los
valores experimentales en
un intervalo amplio de
molalidades.
En la figura se presenta un
electrolito 1:1.
No aplicable en molalidades
muy altas. Normalmente
b<0.1mol/kg. No se puede
aplicar para b~1mol/kg
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Mediciones indirectas de coeficientes
de actividad en electrolitos
El coeficiente de actividad del solvente
depende de la concentracin de actividad del
soluto. Conociendo el coeficiente de actividad
del solvente y utilizando la ecuacin de Gibbs-
Duhem se puede estimar el coeficiente de
actividad del soluto. Los resultados son
confiables para molalidades>0.1 mol/kg y
tiles en el estudio de soluciones de sales
como el agua de mar.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Fisicoqumica II
UNICIT
Diagramas de Fases
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
SISTEMAS DE DOS COMPONENTES
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Regla de las Fases
Recordemos: para un sistema multicomponente
sin reaccin qumica
= 2 +
Donde
F = grados de libertad del sistema
= nmero de fases del sistema
m = nmero de componentes del sistema
Para un sistema de dos componentes y dos fases F=2.
Estos grados de libertad son presin y composicin (T
cte.) o temperatura y composicin (P cte.)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas de presin de vapor
Consideremos una mezcla binaria ideal de
lquidos voltiles A y B a temperatura T donde:
P= presin de la mezcla
x
A
= fraccin molar del componente A
x
B
= fraccin molar del componente B
P
*
A
=presin de vapor del componente A puro
P
*
B
=presin de vapor del componente B puro
De acuerdo a la Ley de Raoult:
P= P
A
+ P
B
= x
A
P
*
A
+ x
B
P
*
B
= P
*
B
+ (P
*
A
-P
*
B
) x
A
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas de presin de vapor
Esta expresin:
P= P
A
+ P
B
= x
A
P
*
A
+ x
B
P
*
B
= P
*
B
+ (P
*
A
-P
*
B
) x
A
Nos indica que la presin de vapor total, a una
temperatura T determinada, vara linealmente
con la composicin, desde P*
B
a P*
A
a medida
que x
A
vara desde 0 a 1.
Recordemos que estamos analizando el tema
bajo el modelo de Raoult y se aplica a soluciones
ideales.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas de presin de vapor
A 35C la presin de vapor del benceno es
19583 Pa y la presin de vapor del tolueno es
6181 Pa.
Para una mezcla Benceno-Tolueno podemos
graficar la presin total en funcin de la
fraccin molar de Benceno
A continuacin una tabla de datos en funcin
de la fraccin molar de Benceno.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagrama de presin de vapor
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
x
A
P P
A
P
B
P
A
+P
B
0 6,181 0 6,181 6,181
0.1 7,521 752 6,769 7,521
0.2 8,861 1,772 7,089 8,861
0.3 10,201 3,060 7,141 10,201
0.4 11,542 4,617 6,925 11,542
0.5 12,882 6,441 6,441 12,882
0.6 14,222 8,533 5,689 14,222
0.7 15,562 10,893 4,669 15,562
0.8 16,902 13,522 3,380 16,902
0.9 18,242 16,418 1,824 18,242
1 19,583 19,583 0 19,583
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
0
2,000
4,000
6,000
8,000
10,000
12,000
14,000
16,000
18,000
20,000
0 0.2 0.4 0.6 0.8 1
P
r
e
s
i
n
d
e
v
a
p
o
r
d
e
l
a
m
e
z
c
l
a
(
P
a
)
Fraccin molar de Benceno, xA
P PA PB
Mezcla Benceno Tolueno a 35C
Compuesto A: Benceno
Compuesto B: Tolueno
Variacin de la presin de vapor total de una mezcla
binaria cuando se cumple la ley de Raoult.
Ejemplo 1
A 90C la presin de vapor de 1,2-
dimetilbenceno es 20 kPa y la de 1,3-
dimetilbenceno es 18 kPa. Cual es la
composicin de una mezcla lquida que hierve
a 90C cuando la presin es 19kPa? Cual es la
composicin del vapor producido?
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 1
Usando la expresin
P=
+ (
Asumiendo A como 1,2-dimetilbenceno:
=
19 18
20 18
=
1
2
Por lo que
=
1
2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 1
Para calcular la composicin del vapor
debemos usar la Ley de Dalton.
Como nuestra solucin es Raoultiana:
Luego
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo 1
Luego la composicin de nuestra mezcla es:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Componente Fraccin molar
lquido (x)
Fraccin molar
vapor (y)
1,2-dimetilbenceno 0.500 0.526
1,3-dimetilbenceno 0.500 0.474
Composicin del vapor
Segn la Ley de Dalton, las fracciones molares en la fase
vapor y
A
e y
B
son:
Para una mezcla ideal que cumple con la Ley de Raoult
tenemos:
= 1
1 +
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Composicin del vapor
Para un soluto no voltil
tendremos que P
*
B
=0 y
no har contribucin al
vapor, y
B
=0.
Si graficamos y
A
vs x
A
para diversas razones
P
*
A
/P
*
B
>1, tendremos
que en todos los casos
y
A
>x
A
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
0.00
0.10
0.20
0.30
0.40
0.50
0.60
0.70
0.80
0.90
1.00
0 0.2 0.4 0.6 0.8 1
F
r
a
c
c
i
n
M
o
l
a
r
d
e
A
e
n
e
l
v
a
p
o
r
,
y
A
Fraccin molar de A en el lquido, x
A
Influencia de la relacin de presiones de vapor
Solvente/Soluto en la composicin del vapor en soluciones
ideales.
10
1
2
4
25
50
100
500
1000
Razn
entre las
presiones
de vapor
P
*
A
/P
*
B
Relacin de la presin total con la
composicin del vapor
Podemos calcular la presin total del vapor en forma
similar a la composicin y
A
.
=
= (1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Relacin de la presin total con la
composicin del vapor
=
1 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Composicin del vapor
=
1
+ 1
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Composicin del vapor
La expresin anterior la
podemos graficar respecto
de y
A,
lo que nos da la
relacin entre la
composicin del vapor y la
presin. La relacin
se
indica en las curvas-
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
0.00
0.10
0.20
0.30
0.40
0.50
0.60
0.70
0.80
0.90
1.00
0.00 0.20 0.40 0.60 0.80 1.00
P
r
e
s
i
n
t
o
t
a
l
r
e
f
e
r
i
d
a
a
l
a
p
r
e
s
i
n
d
e
v
a
p
o
r
d
e
A
,
P
/
P
*
A
Fraccin molar del componente A en el vapor, yA
1000 1
2 10
25 50
Influencia de la relacin de presiones de vapor
Soluto/Solvente en la composicin del vapor
Diagrama lquido vapor
Podemos combinar en un solo grfico la presin
de vapor en funcin de la composicin de la fase
lquida y de la fase vapor.
Para ello definimos un eje de abscisas z que
representa la fraccin molar del componente A
en el lquido y en el vapor.
En el eje de ordenadas leemos la presin de
vapor de la solucin desde dos curvas diferentes,
una que representa la Ley de Raoult y otra que se
desprende de la Ley de Dalton.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagrama lquido vapor
Tomemos como ejemplo la mezcla benceno-tolueno de
nuestro ejemplo inicial.
Asumiendo que tiene un comportamiento ideal, es decir
que cumple la ley de Raoult podemos graficar, para una
temperatura determinada, la presin de vapor para la
fraccin molar en la fase lquida, lo que nos da una lnea
recta, y la presin de vapor para la fraccin molar en fase
vapor que nos arroja una curva cncava.
Para una presin determinada la intercepcin con las
curvas nos indicarn las composiciones de las mezclas de
vapor y lquido que estn en equilibrio para ese sistema.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagrama lquido vapor
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
0
2,000
4,000
6,000
8,000
10,000
12,000
14,000
16,000
18,000
20,000
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
P
r
e
s
i
n
d
e
v
a
p
o
r
d
e
l
a
s
o
l
u
c
i
n
,
P
a
Fraccin molar de A, zA
Dependencia de la presin de vapor total de la solucin
en funcin de la fraccin molar de A en el sistema
xA yA
P
*
B
P
*
A
x
A
y
A
z
A
Lquido
Vapor
Diagrama lquido vapor
Consideremos un punto que est en la zona
de dos fases, lquida y vapor.
Sea z
A
la composicin global de la mezcla en el
compuesto A; luego z
B
=(1-z
A
) ser la
composicin en B.
Consideremos que hay n moles en la mezcla,
luego n
A
=nz
A
, y n
B
=nz
B.
La cuestin ahora es
que fraccin de los moles de A y de B estn en
la fase lquida y en la fase vapor.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Regla de la Palanca
Sea:
n el nmero de moles totales, n
L
el nmero de moles de lquido,
n
V
el nmero de moles de vapor, z
A
la fraccin molar global del
compuesto A, x
A
la fraccin molar en fase lquida, y
A
la fraccin
molar en fase slida.
=
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas temperatura composicin
En un diagrama
temperatura composicin,
los lmites representan las
fases que estn en
equilibrio a diferentes
temperaturas y a una
presin determinada,
generalmente 1 atmsfera.
Ntese que la fase lquida
se representa en la parte
inferior del diagrama.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Fase
Vapor
Fase
Lquida
Lquido
+
Vapor
Diagramas temperatura composicin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Para construir un diagrama temperatura
composicin para una solucin de
comportamiento ideal se requiere conocer P*
A
y P*
B
como funcin de la temperatura.
Si P es la presin constante a la que se
generar el grfico, entonces:
=
= 1
Diagramas temperatura composicin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Luego
=
+ 1
Luego, para cualquier T podemos determinar las
presiones de vapor de los compuestos puros y
determinar las fracciones molares en el lquido.
Diagramas temperatura composicin
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Para la fase gaseosa:
Destilacin de mezclas
Al calentar un lquido que est
en a
1
hasta a
2
este hierve a T
2
,
la composicin del lquido en
a
2
es la misma que en a
1
y la
del vapor es a
2
.
Al condensar a
2
se obtiene a
3
,
el que al hervir genera un
vapor a
3
el que al condensar
entrega un lquido a
4
.
Repitiendo esta operacin
vamos obteniendo un lquido
cada vez ms concentrado en
A.
Esto se llama destilacin
fraccionada y cada etapa es un
plato terico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Azetropos
Hay casos en que los diagramas de fases muestran un
mximo o un mnimo, desvindose notoriamente de la
idealidad.
No siempre las desviaciones de la idealidad generan un
mximo o un mnimo. Sin embargo cuando aparece,
trae consigo implicancias importantes de origen
prctico para los procesos de destilacin ya que al
alcanzar el lquido la composicin de ese punto, se
comporta como un compuesto nico donde la mezcla
de lquidos y de gases tienen igual composicin. Estas
mezclas se denominan azetropos.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Azetropos
Azetropo de mximo Azetropo de mnimo
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Lquidos no miscibles
En el equilibrio hay una diminuta cantidad de B
disuelto en A y de A disuelto en B: ambos lquidos
estn saturados en el otro componente.
La presin de vapor de la mezcla es
Si la temperatura aumenta hasta que la presin alcanza
ese valor la mezcla hierve. La mezcla normalmente
hierve a una presin menor que la suma de las
presiones de vapor por separado, pues lo hace cuando
alcanza la presin atmosfrica y no cuando cada
componente por separado alcanza 1 atmsfera de
presin de vapor.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Lquidos no miscibles
En el caso (a) la ebullicin
genera un fuerte agitacin
manteniendo cada liquido
saturado en el otro. La presin
de vapor es 1 atmsfera y la
temperatura es homognea.
Es la base para la destilacin
por vapor.
En el caso (b) los dos lquidos
van a hervir cuando cada uno
por separado alcance 1
atmsfera de presin de vapor,
y eso ser a diferentes
temperaturas para cada
lquido.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Destilacin por arrastre de vapor
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas de fase lquido lquido
Lquidos parcialmente
miscibles. Una fase de A
saturado en B y otra fase de
B saturado en A.
Ejemplo: sistema hexano-
nitrobenceno.
Al interior de la campana
hay dos fases que se
reparten segn la regla de
la palanca.
Sobre la Tcs los compuestos
son completamente
miscibles en cualquier
proporcin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo
Se prepara una mezcla
de 50g de hexano (0.59
mol de C
6
H
14
) y 50g de
nitrobenceno (0.41 mol
de C
6
H
5
NO
2
) a 290K.
Cul es la composicin
de las fases y sus
proporciones?
A qu temperatura se
debe calentar la muestra
para obtener una nica
fase?
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo
Denominemos por H el hexano y por N el
nitrobenceno.
Para x
N
=0.41 y T=290K la mezcla se encuentra
en la zona de dos fases.
La recta horizontal a T=290 corta la campana
en x
N
=0.35 y x
N
=0.83.
Segn la regla de la palanca
0.35
0.83
=
0.83 0.41
0.41 0.35
= 7.00
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Ejemplo
Es decir, segn la regla de la palanca hay siete
veces ms cantidad de mezcla con x
N
=0.35
que x
N
=0.83.
Total de moles: 1
Luego
moles de x
N
=0.35: 0.875
moles de x
N
=0.83: 0.125
Si seguimos calentando la mezcla sobre 292K
ingresaremos en la zona de una fase.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Diagramas de fase slido lquido
Sistemas a T<T
ebullicin
a
1
a
2
:
sistema ingresa en zona de
dos fases: Lquido+B. B se deposita
puro y en lquido restante predomina
A.
a
2
a
3
: aumenta la cantidad de
slidos. La regla de la palanca nos
dice que la proporcin es 50/50
aproximadamente.
a
3
a
4
: al final de este paso hay
menos lquido que en a
3
. Su
composicin es e. Este lquido se
congela y se obtiene un sistema de
dos fases, A y B puros.
e: punto eutctico. Mezcla con
menor punto de fusin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Eutcticos
Eutctico: de fcil fusin (griego)
Lquido de composicin eutctica se congela a
una temperatura nica. Sin separacin de sus
componentes.
Slido de composicin eutctica: funde a una
temperatura nica, sin cambio en su
composicin.
Deteccin de eutcticos: para encontrar puntos
eutcticos se realizan curvas de enfriamiento de
las mezclas. Una meseta revelar un eutctico.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Sistemas reaccionantes
En este caso el
compuesto A reacciona
con el compuesto B
para formar el
compuesto C. Una
especie qumicamente
diferente de A y de B.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
Fusin incongruente
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
TMC Fisicoqumica II S04.14
Problema 10
En el punto de fusin normal del NaCl, 801C, su entalpa de fusin vale 28.8 kJ/mol, la densidad del
slido es 2,165 g/cm3 y la densidad del lquido es 1,733 g/cm3. Qu aumento de presin se necesita
para elevar 1,00 C su punto de fusin?
La ecuacin que aplicamos es:
Hsl= 28.8 kJ/mol
s= 2.165 g/cm3
l= 1.733 g/cm3
Tf normal= 801 C 1074.15 K
Solucin
1) Reacomodamos la ecuacin anterior:
2) Establecemos todos los datos en unidades SI
Masa molecular NaCl= 58.44 kg/kgmol
Hsl= 28800 J/mol 1 J/J 1000 gmol/kgm 2.88E+07 J/kg mol
s= 2.165 g/cm3 1.00E-03 kg/g 1.00E+06 cm3/m3 2165 kg/m3
l= 1.733 g/cm3 1.00E-03 kg/g 1.00E+06 cm3/m3 1733 kg/m3
Tf normal= 801 C 1074.15 K
vs= 4.62E-04 m3/kg 0.0269931 m3/kgmol
vl= 5.77E-04 m3/kg 0.0337219 m3/kgmol vl-vs= 0.006729 m3/kgmol
Tf n+1K= 1075.15 K T2-T1 1 1/T1= 0.000931
1 at 1.0133E+05 Pa
P1= 1.0133E+05 Pa
Hsl= 2.88E+07 J/kgmol
1/v= 148.6149533 kgmol/m3
1/T1= 0.000930969 1/K
P2= 4.0860E+06
P2/P1 4.0323E+01
Incremento 39 atmsferas.
2
1
=
ln
2
=
1
2
1
Ejemplo 9
Calcule el punto de fusin del hielo a 100 atmsferas con los siguientes datos:
Calor latente de fusin del agua 79,7cal/g en el punto normal de fusin
= 0,917 g/cm3 para el hielo a 0C y 1 atm
= 1,000 g/cm3 para el agua a 1 atm y 0C
Masa molecular agua: 18 kg/kgmol
P= 100 at 1.01332E+05 Pa/at 1.01332E+07 Pa
Hsl= 79.7 cal/g 4.1868 J/cal 1000 g/kg 333688 J/kg
s= 0.917 g/cm3 1.00E-03 kg/g 1.00E+06 cm3/m3 9.17E+02 kg/m3
l= 1 g/cm3 1.00E-03 kg/g 1.00E+06 cm3/m3 1.00E+03 kg/m3
vs= 1.09E-03 m3/kg 18 kg/kgmol 0.01962923 m3/kgmol
vl= 1.00E-03 m3/kg 18 kg/kgmol 0.018 m3/kgmol
P1= 1.03E+05 Pa
T1= 273.15 K
1.00E+07 Pa
Vsl= -0.0016292 m3/kgmol
Hsl= 6006383.28 J/kgmol
T2= 272.4 K
=
1
2
1
2
=
2
+
1
Ejemplos sesin 5 21 abril 2014
Problema 3
A 25C, la densidad de una solucin de etanol/agua al 50% en masa es 0.914g/cm3. Si el volumen
molar parcial del agua en la solucin es 17.4cm3/mol, Cul es el volumen parcial del etanol?
Base de clculo: ETOH CH3CH2OH
1000 cm3 de solucin C 2 12 24
sol= 0.914 g/cm3 H 6 1 6
masa sol: 914 g O 1 15.9994 15.9994
Masa ETOH 457 45.9994
Masa H2O 457
MW ETOH 46
MW H2O 18
V=n1V1+n2V2
V 1000 cm3
n etoh 9.934783 gmol
V etoh 56.2 cm3/gmol
n H2O 25.38889 gmol
V H2O 17.4 cm3/gmol
Vetanol= (V-n
H2O
V
H2O
)/n
etanol
56.2 cm3/mol
Ejemplos sesin 5 21 de Abril de 2014
Ejemplo 1
Una disolucin acuosa de AgNO3 con una composicin del 12,000% en peso de AgNO3 tiene una
densidad de 1,1080 g/cm3 a 20 C y 1 atm. Calcule la fraccin molar, la concentracin molar a 20 C y
1 atm, y la molalidad del soluto AgN03.
AgNO3 H2O
Ag 107.8682 H 1
N 14 O 15.9994
O 15.9994
AgNO3 169.8664 g/gmol H2O 17.9994 g/gmol
Base de clculo
1 kg de H2O
% AgNO3 12.00%
%w H2O 88.000%
Masa sol: 1.136364 kg de solucin
Masa AgNO3: 0.136364 kg de Ag NO3
Masa de Agua: 1.00000 kg de agua
Moles AgNO3: 0.80277 gmol
Moles de agua 55.55741 gmol
Clculo fraccin molar:
nt= 56.36018 gmol
xAgNO3 0.014244
xH2O 0.985756
Check 1
Concentracin molar:
Volumen de solucin:
V= 1025.599 cm3
1.025599 l
cAgNO3= 0.782733 gmol/l
Molalidad
m= 0.80277 gmol/kg de solvente
Ejemplos sesin 5 21 de Abril de 2014
Ejemplo 2
Se prepara una disolucin disolviendo 555,5 g de sacarosa, C12H22O11, en 600 mL de agua, y diluyendo
con agua hasta un volumen final de 1.0000 L. La densidad de la disolucin final es 1.2079 g/cm3. Calcule la
fraccin molar, la molalidad y el porcentaje en peso de la sacarosa en esta disolucin.
Solucin
Fraccin molar
Masa molecular sacarosa:
C 12 12 144
H 1 22 22
O 15.9994 11 175.9934
341.9934
Masa molecular agua
H 1 2 2
O 15.9994 1 15.9994
17.9994
V solucin: 1 l 1000 cm3
solucin 1.2079 g/cm3
Masa solucin 1207.9 g
Sacarosa 555.5 g
Agua total 652.4 g
n sacarosa 1.6243 gmol
n agua 36.24565 gmol
n total 37.86995 gmol
x sacarosa 0.042892
x agua 0.957108
chck 1
Molalidad
n sacarosa 1.6243 gmol
masa de H2O 652.4 g
molalidad 2.489731 molal gmol/kg solvente
Fracin en peso:
X sac 0.459889
X agua 0.540111
Check 1
Fisicoqumica II Ejemplos sesin 6 10 de Mayo 2014
TMC Pgina 1 de 5
Levine 5 ed problema 12.3
La presin de vapor del agua a 110 C es 1074,6 torr. Calcule la presin de vapor a 110C de una
disolucin al 2,00% en peso de sacarosa (C
12
H
22
O
11
) en agua. Indique cualquier aproximacin que
haya utilizado.
T= 110 C 273.15 383.15 K
P= 1074.6 torr 1.33E+02 1.43E+05 Pa
Solucin sacarosa 2% peso
M n x
Agua 98 g 18 g/mol 5.44444 9.99E-01
Sacarosa 2 g 342 g/mol 0.00585 1.07E-03
5.45029
De tablas de vapor de agua tenemos que
vap
H del agua a 110C es:
Hv 2691.5 kJ/kg
Hc 471.3 kJ/kg
vapH 2220.2 kJ/kg 18 kg/kgmol 39963.6 kJ/kmolK
R= 8.3143 J/molK 1 kJ/kgmol 8.3143 kJ/kgmolK
xA= 9.989E-01
ln(xA)= -0.001073537
T*= 110 C 273.15 K 383.15 K
Clculo
T= 383.18 K
T= 0.033 K
Es decir a 1074.6 torr la temperatura de ebullicin aument en 0.033K al agregar un 2% en peso de sacarosa.
A 110C la presin de vapor de la solucin ser la suma de las presiones parciales de vapor.
Disminucin en la presin de vapor:
De acuerdo a la ley de Raoult: P
A
=x
A
*P
*
A,
asumiendo que podemos despreciar la contribucin de la sacarosa
a la presin de vapor, tendremos que P
A
=0.9989*1074.6=1073.4 torr y que P
A
=P.
2.60972E-03
=
1
=
1
383.15
+
0.00107 8.3143
39963.6
Fisicoqumica II Ejemplos sesin 6 10 de Mayo 2014
TMC Pgina 2 de 5
Atkins 5a ed Ejercicio 5.5(a)
La presin de vapor de 500 g de benceno es 400 Torr a 60,6 C, pero cae a 386 Torr cuando 19,0 g de un
compuesto orgnico no voltil fue disuelto en 500 g de benceno. Calcule la masa molar del compuesto.
Masa molecular del benceno: C6H6 Frmula
78 g/mol
P
*
A
= 400 torr a 60.6C
P
*
A
= 386 torr a 60.6C si se agregan 19.0g de un compuesto B a 500g de A.
Estamos agregando un compuesto orgnico no voltil, por lo que su contribucin a la presin de vapor de la
solucin la asumimos nula.
De acuerdo a Raoult:
Luego la fraccin molar del benceno ser 0.965 =x benceno
La fraccin molar del compuesto orgnico ser: 0.035 =x orgnico
Moles de benceno: 6.41 gmol
Moles totales=moles de benceno/x benceno 6.64 gmol
Moles compuesto orgnico= 0.23 gmol
Masa molecular=masa/nmero de moles 81.7 g/gmol
Fisicoqumica II Ejemplos sesin 6 10 de Mayo 2014
TMC Pgina 3 de 5
Levine 5 ed problema 12.12
El punto de ebullicin del CHCl3 es 61,7 C. En una disolucin de 0,402 g de naftaleno (C10H8) en 26,6 g de
CHCl3, el punto de ebullicin aumenta en 0,455 K. Calcule
vap
Hm del CHCI3.
T*A= 61.7 C 273.15 K 334.85 K
T*= 0.455 K
T'A= 335.305 K
n(gmol) x lnx
CHCl3 26.6 g 0.222818 0.9861 -0.014
MCHCl3 119.38 g/gmol
C10H8 0.402 g 0.003136 0.0139 -4.2772
MC10H8 128.17 g/gmol
0.2260 1.0000
R= 8.3143 J/gmolK
1/T= 0.002982359 1/K -4.05248E-06 28678.4
1/T*= 0.002986412 1/K
=
8.3143 0.01398
4.050248 10
6
= 28,678 /
Fisicoqumica II Ejemplos sesin 6 10 de Mayo 2014
TMC Pgina 4 de 5
Levine 5 ed. problema 12.7
Sea W el porcentaje en peso de maltosa en una disolucin acuosa. Se observaron los siguientes descensos
del punto de congelacin en disoluciones acuosas de maltosa:
W (% w/w) 3.0 6.0 9.0 12.0
T
f
(C) -0.169 -0.352 -0.55 -0.765
(a) Demuestre que la ecuacin T
f
= - k
f
m
B
conduce a M
B
= -k
f
w
B
/(T
f
w
A
), donde w
B
y w
A
son las masas de B y de A en la disolucin. (b) Represente los pesos moleculares calculados frente a W
y extrapole el resultado a concentracin cero para obtener el peso molecular verdadero.
(a)
(b)
Base de clculo: 100g de solucin
W
B
(% w/w) 3.0 6.0 9.0 12.0
T
f
(C) -0.169 -0.352 -0.55 -0.765
w
B
3.0 6.0 9.0 12.0
w
A
97.0 94.0 91.0 88.0
M
B
338.0 334.3 330.9 327.3
M
A
18.0 g/gmol
T
*2
= 74611 K
2
R= 8.3143 J/gmolK
fus
H= 335.3 kJ/kg J/g 18 g/gmol 6035.4 J/gmol
K= 102.78 K
MB
341.52 g/mol
MB es la masa molecular
de la maltosa cuando la
concentracin de la
solucin tiende cero
=
2
+1 =
= 1
= 1 +
y = -1.1834x + 341.52
R = 0.9998
326.0
328.0
330.0
332.0
334.0
336.0
338.0
340.0
0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0
A
x
i
s
T
i
t
l
e
Axis Title
MB
MB
Linear (MB)
Fisicoqumica II Ejemplos sesin 6 10 de Mayo 2014
TMC Pgina 5 de 5
Atkins 5a ed Ejercicio 5.13(b)
Prediga la solubilidad ideal del plomo en bismuto a 280 C dado que su punto de fusin es 327 C
y su entalpa de fusin es 5,2 kJ/mol.
Tf= 327 C 273.15 600.15 K
T= 280 C 273.15 553.15 K
fusH= 5.2 kJ/gmol 1000 5200 J/mol
R= 8.3143 J/gmolK
lnxB= -0.088546782
xB= 0.915
xA= 0.085
Masa atmica del plomo 207.2 g/mol
Masa atmica del bismuto 208.98 g/mol
Para 1 kilo de solvente A, en este casoel Bismuto, tendremos
Masa solvente 1000 g
Moles solvente 4.785146904 gmol
Moles totales 56.4687678 gmol
Moles soluto 51.6836209 gmol
Masa soluto 10708.84625 g
Es decir en cada kilo de Bismuto se podran disolver 10.7 kilos de plomo.
Difcil considerar esta solucin como ideal, por lo que el resultado solo se debe tomar como referencial.
Fisicoqumica II
UNICIT
Taller 6:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
Problema 1
La densidad de una disolucin de KI(ac) con
molalidad 1,506 moles/kg es 1,1659 g/cm3 a
20 C y 1 atm. Calcule la molaridad del KI.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Problema 2
En una disolucin acuosa de NaCl de
molalidad 0,1000 moles/kg, a 25 C y 1 atm,
CpH20 = 17,992 cal/(mol K) y Cp NaCl = -17,00
cal/(mol K). Calcule CP para 1000,0 g de dicha
disolucin. Fjese que esta cantidad de
disolucin no contiene 0,1000 moles de NaCl.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Problema 3
Escriba la ecuacin que define la energa de
Helmholtz molar parcial del componente i en
una disolucin e indique claramente a qu
magnitud se refiere cada uno de los smbolos
que aparecen en su definicin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
Problema 4
Las densidades del H
2
0 y del CH
3
OH a 25 C y 1
atm son 0,99705 y 0,78706 g/cm3,
respectivamente. Algunos datos de
mez
V/n
frente a x
H2O
para disoluciones de estos dos
compuestos, a 25 C y 1 atm, son:
Determine los volmenes molares parciales
del agua a: x=0.0; 0.4; 0.6.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
mez
V (cm
3
/mol)
-0.34 -0.6 -0.8 -0.945 -1.01 -0.98 -0.85 -0.615 -0.31
x
H2O
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
Problema 5
Demuestre la validez del mtodo de la ordenada (en la
figura) en la determinacin de volmenes molares parciales
de una disolucin con dos componentes siguiendo el
procedimiento siguiente. (Todas las ecuaciones de este
problema corresponden a T y P constantes.)
(a) Sea z =
mez
V/n, donde n = n
A
+n
B
. Verifique que =
(b)Calcule
de la ecuacin de (a) para demostrar que
+ +
(c)Utilice la relacin
y el
resultado de (b) para demostrar que
}
Compruebe que la ordenada de la recta tangente en
=
1
.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Problema 5
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Problema 6
Sea V el volumen de una disolucin acuosa de NaCl a 25 C y 1 atm que contiene 1000 g
de agua y n
B
moles de NaCl. Se puede encontrar la siguiente frmula emprica que
reproduce correctamente los datos experimentales:
V = a + bn
B
+ cn
B
3/2
+ kn
B
2
cuando n
A
M
A
= 1 kg
a = 1002,96 cm3, b = 16,6253 cm
3
/mol, c = 1,7738 cm
3
/mol
3/2
, k = 0,1194 cm
3
/mol
2
(a) Demuestre que el volumen molar parcial V
B
del NaCl es
V
B
= b + (3c/2)n
B
1/2
+ 2kn
B
cuando n
A
M
A
= 1 kg
(b) Calcule V
NaCl
para una disolucin con molalidad de NaCl m
B
= 1,0000 mol/kg.
(c) Si V
B
=16.6 cm3/gmol, demuestre que el volumen molar parcial del agua en la
disolucin es V
A
= (M
A
/ 1000 g ) ( a 1/2cn
B
3/2
kn
B
2
) cuando n
A
M
A
= 1 kg
(d ) Demuestre que los resultados de los apartados (a) y (c) se pueden escribir en la
forma:
V
B
= b + (3c/2)(m
B
kg)
1/2
+ 2km
B
kg
V
A
= (M
A
/1000 g)(a 1/2cm
B
3/2
kg
3/2
- km
B
2
kg
2
)
Dado que V
A
, V
B
y m
B
son magnitudes intensivas, no es necesario especificar n
A
en
estas ecuaciones.
(e) Calcule VH
2
O para una disolucin con m
B
= 1,0000 moles/kg.
( f ) Calcule V
NaCl.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
9
Fisicoqumica II
UNICIT
Taller 8
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
PRESIN OSMTICA
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Problema 1
La presin osmtica de una disolucin acuosa
de albmina bovina con
B
= 0,0200 g/cm3 es
6,1 torr a 0 C. Estime el peso molecular de
esta protena. Explique por qu su respuesta
es slo una estimacin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Problema 2
Para una muestra de un poliaminocido sinttico en
agua a 30 C (densidad 0,996 g/cm3), la determinacin
de la presin osmtica condujo a los siguientes valores
de la diferencia de altura h entre los lquidos en los
tubos capilares de la figura.
Transforme las medidas de alturas en presiones y
calcule el peso molecular promedio en nmero del
polmero.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
h/cm 2.18 3.58 6.13 9.22
B
/(g/dm
3
) 3.71 5.56 8.34 11.12
Problema 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
ACTIVIDAD
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Problema 3
Al medir el equilibrio entre las fases lquidas y
gaseosa de una solucin de acetona (A) y metano
(M) a 57,2C y a 1.00 atm, se encontr que x
A
=
0.400 cuando y
A
=0,516. Calcule las actividades y
los coeficientes de actividad de ambos
componentes en esta solucin basndose en la
ley de Raoult . Las presiones de vapor de los
componentes puros a esta temperatura son: p
A
*
=105 kPa y p
M
*=73.5 kPa. (x
A
es la fraccin molar
en el lquido e y
A
es la fraccin molar en el vapor.)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Problema 4
A continuacin se indican los coeficientes de
actividad medio de soluciones acuosas de
NaCl a 25C. Verifique que cumplen la ley
lmite de Debye-Hckel y que con la ley
extendida se obtiene mayor coincidencia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
b/(mmol/kg) 1 2 5 10 20
0.9649 0.9519 0.9275 0.9024 0.8712
Fisicoqumica II
UNICIT
Taller 9
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
Problema 1
Para una disolucin de acetona-cloroformo a
35,2 C con x
ac
= 0,4188, emplee la Tabla
siguiente para calcular
l,ac
y
l,c
. Calcule
mez
G
cuando se mezclan 0,4188 moles de acetona y
0,5812 moles de cloroformo a 35,2 C y 1 bar.
(Respuesta: 0,751, 0,820, -2347 J.)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Problema 1
x
ac
y
ac
P/torr
0.0000 0.0000 293.0
0.0821 0.0500 279.5
0.2003 0.1434 262.0
0.3365 0.3171 249.0
0.4188 0.4368 248.0
0.5061 0.5625 255.0
0.6034 0.6868 267.0
0.7090 0.8062 286.0
0.8147 0.8961 307.0
0.9397 0.9715 332.0
1.0000 1.0000 344.5
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Problema 2
Para las disoluciones de H
2
0 y H
2
0
2
a 333,15 K,
algunas de las composiciones del lquido y del
vapor, junto a las presiones de vapor totales,
son:
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
x
H2O
0.100 0.300 0.500 0.700 0.900
y
H2O
0.301 0.696 0.888 0.967 0.995
P/kPa 3.00 5.03 8.33 12.86 17.77
Problema 2
Las presiones de vapor a 333,15 K de los lquidos
puros son P
H2O
* = 19,92 kPa y P
H2O2
*=2,35 kPa.
Para una disolucin a 333,15K con x
H2O
= 0.300,
calcule
(a) y a del H
2
0 y del H
2
0
2
(b) y a del H
2
0 y del H
2
0
2
, tomando como
disolvente el H
2
0 ;
(c) mezG al obtener 125 g de esta disolucin a
partir de los componentes puros a T y P
constantes.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
Problema 3
A 25 C, la presin de vapor de una disolucin
de KCl 4.800 mol/kg en agua es 20,02 torr. La
presin de vapor del agua pura a 25 C es
23,76 torr. Para el disolvente de esta
disolucin de KCl, calcule:
A
y a
A
si x
A
se calcula usando el H
2
0 , K
+
(ac)
y Cl
-
(ac)
como los componentes de la disolucin
A
y a
A
si x
A
se calcula usando el H
2
0 y el KCl
(ac)
como los componentes de la disolucin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Problema 3
En el primer caso, asumiendo que el cloruro
de potasio est completamente disociado:
Actividad del agua:
=
20.02
23.76
= 0.843
Clculo de la fraccin molar del agua:
Hay 4.8 moles de KCl en 1 kilo de agua.
Moles de agua:
=
1000
18
= 55.5
Dado que el KCl se supone disociado tenemos 4.8
moles de K
+
y 4.8 moles de Cl
-
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Problema 3
Luego el total de moles en la solucin
disociada es: 55.5+4.8+4.8=65.1 gmol
=
55.5
65.1
= 0.853
=
=
0.843
0.853
= 0.989
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
Problema 1
x
ac
y
ac
P/torr x
cl
y
cl
P
ac
(Dalton)Pcl (Dalton) x
ac
P
ac
* x
cl
P
cl
*
l,ac
l,cl
0.0000 0.0000 293.0 1 1 0.00 293.00 0.00 293.00 0.0000 1.0000
0.0821 0.0500 279.5 0.9179 0.95 13.98 265.53 28.28 268.94 0.4941 0.9873
0.2003 0.1434 262.0 0.7997 0.8566 37.57 224.43 69.00 234.31 0.5445 0.9578
0.3365 0.3171 249.0 0.6635 0.6829 78.96 170.04 115.92 194.41 0.6811 0.8747
0.4188 0.4368 248.0 0.5812 0.5632 108.33 139.67 144.28 170.29 0.7508 0.8202
0.5061 0.5625 255.0 0.4939 0.4375 143.44 111.56 174.35 144.71 0.8227 0.7709
0.6034 0.6868 267.0 0.3966 0.3132 183.38 83.62 207.87 116.20 0.8822 0.7196
0.7090 0.8062 286.0 0.291 0.1938 230.57 55.43 244.25 85.26 0.9440 0.6501
0.8147 0.8961 307.0 0.1853 0.1039 275.10 31.90 280.66 54.29 0.9802 0.5875
0.9397 0.9715 332.0 0.0603 0.0285 322.54 9.46 323.73 17.67 0.9963 0.5355
1.0000 1.0000 344.5 0 0 344.50 0.00 344.50 0.00 1.0000 0.0000
P
ac
* = 344.5 torr
Pcl* = 293 torr
Para x
ac
=0.4188
a
cl
0.314445283 ln(acl) -1.15695
a
ac
0.476701706 ln(aac) -0.74086
R= 8.314 J/kgmoK
T= 35.2 C 308.35 K
mez
G= -2,346 kJoules
Problema 2
x
H2O
0.100 0.300 0.500 0.700 0.900
y
H2O 0.301 0.696 0.888 0.967 0.995
P/kPa 3.00 5.03 8.33 12.86 17.77
x
H2O2 0.900 0.700 0.500 0.300 0.100
y
H2O2
0.699 0.304 0.112 0.033 0.005
P
H2O2
/kPa(Dalton) 2.097 1.529 0.933 0.424 0.089
P
H2O2
/kPa(Raoult) 2.115 1.645 1.175 0.705 0.235
Y 2.330 2.184 1.866 1.415 0.889
Ley de Henry
Dalton P
B
=y
B
P
Raoult P
B
=x
B
P
B
*
K= 0.6204
125 g de mezcla
a gramos de agua
b gramos de perxido
a+b=125
a/18=nH2O 4.40677778
b/34=nH2O2 2.333nH2O nH2O= b/34*2.333 b/79.3222= a/18
nH2O/(nH2O+nH2O2)= 0.3 2.33333333 b= 79.3222/18*a
0.7nH2O=0.3nH2O2 b= 4.407a
nH2O2= 2.333nH2O a+b= 125
a+4.407a= 125
5.407a= 125
a= 23.12 g
b= 101.88 g
nH2O= 1.284343
nH2O2= 2.996524
ntot 4.280867 gmol
xH2O= 0.3
xH2O2= 0.7
mezG= -9762 Joules
Problema 2
T= 333.5 K
P
H2O
*= 19.92 kPa
p
H2O2
*= 2.35 kPa
x
H2O
= 0.3
H2O
= 0.5858
H2O2
0.9296
a
H2O
0.1757
a
H2O2
0.6507
Tomando como solvente el agua
H2O
0.586
H2O2
3.521
a
H2O
0.176
a
H2O2
2.465
mezG
125g de sol
y = 0.4633x
4
- 1.9497x
3
+ 0.5513x
2
+ 2.6449x + 0.6204
R = 1
0.000
0.500
1.000
1.500
2.000
2.500
-0.200 0.000 0.200 0.400 0.600 0.800 1.000
Henry H2O2
Henry H2O2
Poly. (Henry H2O2)
Taller 6
TMC Pgina 1 de 6
Problema 1
La densidad de una disolucin de KI(ac) con molalidad 1,506 moles/kg es 1,1659 g/cm3 a 20 C y 1 atm.
Calcule la molaridad del KI.
El yoduro de potasio , KI, tiene una masa molecular de:
Elemento Peso atmico
K 39.1
I 126.92
KI 166.02
Base de clculo: 1 lt de solucin
Masa de solucin 1166 g
Masa de KI= x 233.09
Masa de agua= 1165.9-x 932.81
Moles de KI= x/166.02 5.6187
Molalidad= (x/166.02)/((1165.9-x)/1000)=1.506 1.5051
1.506
Taller 6
TMC Pgina 2 de 6
Problema 2
En una disolucin acuosa de NaCl de molalidad 0,1000 moles/kg, a 25 C y 1 atm, CpH20 = 17,992 cal/(mol K)
y Cp NaCl = -17,00 cal/(mol K). Calcule Cp para 1000,0 g de dicha disolucin. Fjese que esta cantidad de
disolucin no contiene 0,1000 moles de NaCl.
Para calcular una propiedad de una solucin hacemos uso de la frmula:
Como conocemos los Y
i
necesitamos los x
i
para calcular la capacidad calorfica total.
La solucin de NaCl tiene 0.1 moles por kilo de solvente.
Pesos moleculares
NaCl H2O
Na 23 2H 2
Cl 35.5 O 16
58.5 18
1 kilo de solvente tiene: 1000 gramos de agua
55.5556 gmol de agua
0.1 mol de NaCl 0.1 gmol de NaCl
Total moles 55.6556
x H2O 0.9982 Cp H2O 17.992 cal/mol K
xNaCl 0.0018 Cp NaCl -17 cal/mol K
Test 1
Cp Solucin: 17.929 cal/molK
1 mol de solucin tiene una masa de:
18.07276902 g/gmol
Cp sol= 17.929 cal/mo 18.0728 g/gmol 0.99205 cal/gK 1000 g/kg 992.1
Cp sol= 992.05 cal/kgK
=
Taller 6
TMC Pgina 3 de 6
Problema 3
Escriba la ecuacin que define la energa de Helmholtz molar parcial del componente i en una disolucin e
indique claramente a qu magnitud se refiere cada uno de los smbolos que aparecen en su definicin.
Respuesta
A' = (A/n
i
)
T,Pnji
, donde A es la energa de Helmholtz de la solucin, n
i
es el
nmero de moles de i en la solucin, T y P son temperatura y presin,
y n
ji
indica que todos los nmeros de moles excepto i se mantienen constantes.
Taller 6
TMC Pgina 4 de 6
Problema 4
Las densidades del H20 y del CH3OH a 25 C y 1 atm son 0,99705 y 0,78706 g/cm3, respectivamente.
Algunos datos de mezV/n frente a xH2O para disoluciones de estos dos compuestos, a 25 C y 1 atm, son:
mez
V (cm
3
/mol)
-0.34 -0.6 -0.8 -0.95 -1.01 -0.98 -0.85 -0.62 -0.31
x
H2O
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
Determine los volmenes molares parciales del agua a: x=0.0; 0.4; 0.6.
Corresponde al volumen parcial molar del componente puro.
Componente (g/cm3) M(g/gmc*(mol/cmV
*
m
(cm3/mol)
Agua 0.99705 18 0.05539 18.05
Metanol 0.78706 32 0.02460 40.66
Graficamos el
mez
V versus la fraccin molar de agua (ver Grfico Delta Mezcla V)
Usamos el mtodo de la tangente para determinar V
H2O
Mtodo numrico
Una correlacin polinomial de grado 5 nos da:
exp exp 0 0.4 0.6
a -7.3718 5 -36.859 4 0 -0.9436 -4.77693
b 15.6906 4 62.7624 3 0 4.0168 13.5567
c -10.1821 3 -30.5463 2 0 -4.8874 -10.9967
d 5.6683 2 11.3366 1 0 4.5346 6.80196
e -3.7899 1 -3.7899 0 -3.790 -3.790 -3.790
f -0.0092 0 0
-3.790 -1.069 0.795
Y=mx+B
Caso 1
m -3.7899 -1.07 0.795
x 0 0.4 0.6
y 0 -0.95 -0.98
B 0 -0.52 -1.457
x=1 -3.7899 -1.59 -0.662
14.3 16.5 17.4 Clculo con tangentes derivadas poli.
valores de xH2O
Taller 6
TMC Pgina 5 de 6
Mtodo Grfico
Lnea azul: Lnea roja lnea verde
Pendiente
x1 0 0 1
y1 0 -0.5 -0.59
x2 0.23 0.4 0.6
y2 -1 -0.95 -0.98
m=(y2-y1)/(x2-x1) -4.347826 -1.125 0.975
y=mx+b
b=y-mx 0 -0.5 -1.565
x=1 -4.347826 -1.625 -0.59
Vmeoh-V*meoh 0 -0.5 -1.565
Vh2o-V*h2o -4.347826 -1.625 -0.59
V*meoh 40.657637
V*h2o 18.053257
0 0.4 0.6
Vh20 13.71 16.43 17.46 Clculo con tangentes manuales
14.5 16.5 17.4 Respuestas del libro.
y = -7.3718x
5
+ 15.6906x
4
- 10.1821x
3
+ 5.6683x
2
- 3.7899x - 0.0092
R = 1.0000
-1.2
-1
-0.8
-0.6
-0.4
-0.2
0
0.2
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 1.1
mezV (cm3/mol)
mezV (cm3/mol)
Poly. (mezV (cm3/mol))
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 1
Problema 6 Tarea 2
Sea V el volumen de una disolucin acuosa de NaCl a 25 C y 1 atm que contiene 1000 g de agua y n
B
moles de NaCl. Se puede encontrar la siguiente frmula emprica que reproduce correctamente los
datos experimentales:
V = a + bn
B
+ cn
B
3/2
+ kn
B
2
cuando n
A
M
A
= 1 kg
a = 1002,96 cm3, b = 16,6253 cm3/mol, c = 1,7738 cm3/mol3/2, k = 0,1194 cm3/mol2
(a) Demuestre que el volumen molar parcial V
B
del NaCl es
V
B
= b + (3c/2)n
B
1/2
+ 2kn
B
cuando n
A
M
A
= 1 kg
Por definicin el volumen parcial molar es:
Luego el volumen parcial molar del soluto B, Na Cl, en agua ser:
La expresin para V nos da el volumen de una solucin de NaCl para una cantidad determinada de H2O.
Por lo tanto al derivarla respecto de los moles de NaCl obtendremos el volumen molar parcial del
NaCl para esa cantidad determinada de H2O.
(b) Calcule V
NaCl
para una disolucin con molalidad de
NaCl mB = 1,0000 mol/kg.
a= 1002.96 cm3
b= 16.6253 cm3/mol
c= 1.7738 cm3/mol
(3/2)
k= 0.1194 cm3/mol
2
,,
,,
=
+
3
2
= 1000
= +
3
2
1
2
+2
= 1
TMC
Fisicoqumica II
UNICYT Pgina 1 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Para una molalidad de 1.0000mol/kg de agua, se tiene n
NaCl
=1 mol y N
A
M
A
=1000g
19.5248 cm3/gmol
(c) Si V
B
=16.6 cm3/gmol, demuestre que el volumen molar parcial
del agua en la disolucin es:
V
A
= (M
A
/ 1000 g ) ( a 1/2cn
B
3/2
kn
B
2
) cuando n
A
M
A
= 1 kg
Dado que:
Para 1000g de A, nA ser
Luego
=
=
= +
3
2
= +
3
2
1
2
+ 2
+
3
2
3
2
+2
=
1
2
3
2
=
1
2
3
2
=
1000
1000
1
2
3
2
2
TMC
Fisicoqumica II
UNICYT Pgina 2 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
(d ) Demuestre que los resultados de los apartados (a) y (c) se pueden
escribir en la forma:
V
B
= b + (3c/2)(m
B
kg)
1/2
+ 2km
B
kg
V
A
= (M
A
/1000 g)(a 1/2cm
B
3/2
kg
3/2
- km
B
2
kg
2
)
Dado que V
A
, V
B
y m
B
son magnitudes intensivas, no es necesario especificar
nA en estas ecuaciones.
Por definicin de molalidad:
Entonces
Reemplazamos n
B
por m
B
kg en las expresiones anteriores y se tiene el resultado.
(e) Calcule V
H2O
para una disolucin con m
B
= 1,0000 moles/kg.
V
A
= (M
A
/1000 g)(a 1/2cm
B
3/2
kg
3/2
- km
B
2
kg
2
)
VA= 18.05 cm3/mol M
A
= 18.01534
H 1.00797
O 15.9994
( f ) Calcule V
NaCl
.
El volumen parcial molar a dilucin infinita del cloruro de sodio lo podemos calcular
tomando el lmite de VB cuando nB tiende a cero.
b= 16.6253 cm3/mol
1 =
lim
= lim
0
+
3
2
1
2
+2
=
TMC
Fisicoqumica II
UNICYT Pgina 3 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 2
Chen y Lee estudiaron el equilibrio lquido vapor de ciclohexanol con varios gases a
presiones elevadas (J.-T. Chen and M.-J. Lee, J. Chem. Eng. Data 41, 339 (1996)).
Entre sus datos estn las siguientes mediciones de las fraccin molar de ciclohexanol en
la fase vapor (y) y en la fase lquida (x) a 393.15K en funcin de la presin.
p /bar 10 20 30 40 60 80
y
cyc
0.0267 0.0149 0.0112 0.00947 0.00835 0.00921
x
cyc
0.9741 0.9464 0.9204 0.892 0.836 0.773
Determine la constante de Henry del CO2 en ciclohexanol y calcule el coeficiente de
actividad del CO2.
La ley de Henry nos dice que la presin parcial de vapor de un soluto es igual a la fraccin
molar en el lquido multiplicada por la constante de Henry.
Para la fase gaseosa podemos usar la ley de Dalton de las presiones parciales
Luego
p/bar 10 20 30 40 60 80
y
CO2
0.9733 0.9851 0.9888 0.9905 0.99165 0.99079
x
CO2
0.0259 0.0536 0.0796 0.108 0.164 0.227
y
CO2
P 9.733 19.702 29.664 39.621 59.499 79.263
2
= 1
2
= 1
y = 357.1013x
R = 0.9978
y = 368.9418x
R = 0.9996
0
10
20
30
40
50
60
70
80
90
0 0.05 0.1 0.15 0.2 0.25
P
r
e
s
i
n
p
a
r
c
i
a
l
d
e
C
O
2
(
b
a
r
)
Fraccin molar de CO2 en fase lquida
TMC
Fisicoqumica II
UNICYT Pgina 4 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
En este caso la constante de Henry sobre todo el rango de presiones es 357bar.
Si consideramos el rango bajo de presin, hasta 40 bar, la constante es 369 bar.
Asumiendo KB= 357 bar
P
T
10 20 30 40 60 80
y
B
0.9733 0.9851 0.9888 0.99053 0.99165 0.9908
x
B
0.0259 0.0536 0.0796 0.108 0.164 0.227
B
1.0526 1.0296 1.0439 1.0276 1.0162 0.9781
=
TMC
Fisicoqumica II
UNICYT Pgina 5 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 3 Atkins P5.15
La energa de Gibbs de exceso de soluciones de metilciclohexano (MCH) y
tetrahidrofurano (THF) a 303.15K se expresa como:
en donde x es la fraccin molar de MCH. Calcule la energa de Gibbs de una solucin
de 1.00 mol de MCH y 3.00 moles de THF.
n
i
x
i
nMCH 1 0.25
nTHF 3 0.75
nTOT 4 1
R= 8.31434 J/molK
T= 303.15 K
G
E
molar= 257.2 J/mol
mez
G *= -5669 J
mez
G = -4640 J
= (1 ) 0.4857 0.1077 2 1 +0.0191 2 1
2
TMC
Fisicoqumica II
UNICYT Pgina 6 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 4
A 300K las presiones parciales de vapor de HCl en GeCl4 lquido sonlas siguientes
x
HCl
0.005 0.012 0.019
P
HCl
kPa 32 76.9 121.8
Demuestre que la solucin cumple con la ley de Henry en ese rango de fraccin molar y
calcule el valor de la constante de Henry.
Si el sistema cumple con la Ley de Henry, entonces se cumple que:
siendo B el HCl.
Luego, graficando la presin parcial del HCl versus su fraccin molar debiramos
encontrar una recta cuya pendiente es la constante de Henry.
La recta de regresin tiene un coeficiente lineal de correlacin de 1.0000 y pasa
prcticamente por el origen. La pendiente de la recta es 6414kPa.
y = 6,414.2857x - 0.0714
R = 1.0000
0
20
40
60
80
100
120
140
0 0.005 0.01 0.015 0.02
P
r
e
s
i
n
p
a
r
c
i
a
l
d
e
v
a
p
o
r
d
e
H
C
l
(
P
a
)
Fraccin molar de HCl
Constante de Henry para HCl en GeCl4
TMC
Fisicoqumica II
UNICYT Pgina 7 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 5
Problema 1 Tarea 2
Las densidades del agua y del metanol a 25C y 1 atm son 0.99705 y 0.78706 g/cm
3
repectivamente. Algunos datos de
mez
V frente a x
H2O
para soluciones de estos dos
compuestos, a 25C y 1 at son:
-0.34 -0.6 -0.8 -0.945 -1.01 -0.98
0.1 0.2 0.3 0.4 0.5 0.6
-0.85 -0.615 -0.31
0.7 0.8 0.9
Determine los volmenes molares parciales a: x
H2O
: 0
0.4
0.6
Resuelto en taller 6.1
Problema 6
Problema 2 Tarea 2
Calcule
mez
G,
mez
H,
mez
V y
mez
S para el proceso de mezclar 100g de benceno
con 100g de tolueno a 20C. Suponga una disolucin ideal.
Solucin Compuesto Frmula M n x
Benceno C6H6 78 1.2821 0.5412
Para una solucin ideal: Tolueno C6H5(CH3)92 1.0870 0.4588
Mezcla 2.3690 1.0000
R= 8.31434 J/molK
T= 20 C 278 K
mez
G*= -3776.871821 J
mez
S*= 13.6 J/K
mez
H*=
mez
G*+T*
mez
S*= 0
De la sesin 3 tenemos:
mez
V*= 0
mezV (cm3/mol)
xH2O
mezV (cm3/mol)
xH2O
,
=
,
=
,
=
,
TMC
Fisicoqumica II
UNICYT Pgina 8 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 7
Problema 3 Tarea 2 Levine problema 4.8
Obtenga a partir de la siguiente ecuacin:
la expresin:
para un sistema cerrado de una fase con trabajo P-V solamente, en equilibrio trmico
y mecnico.
Esta expresin proporciona dq durante una reaccin qumica.
Como la reaccin es irreversible, dq TdS.
Reemplazando
Llegamos a:
Problema 8
Problema 4 Tarea 2 Levine problema 4.42
Explique por qu la condicin de igualdad de potenciales qumicos para el hielo en
equilibrio con el agua lquida a 0C y 1 at es equivalente a G=0 para H
2
O
(s)
H
2
O
(l)
.
La condicin general para el cambio de energa de Gibbs a P y T constante es:
Para el sistema hielo-agua
En el caso del sistema hielo-agua:
Adems
Luego
= +
= +
= =
= +
= +
,
=
=1
=
0
,
=
2
+
2
=
2
=
2
,
=
2
+
2
=
2
TMC
Fisicoqumica II
UNICYT Pgina 9 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Integrando entre los estados 1 y 2
Problema 9
Problema 5 Tarea 2 Problema 4.56 Levine
Cuando 3.0 moles de un determinado gas se calientan reversiblemente de 275 K y 1 bar
a 375 K y 1 bar, S es 20.0 J/K. Indique si cuando 3,0 moles de dicho gas se calientan
irreversiblemente de 275 K y 1 bar a 375 K y 1 bar, S ser mayor, menor o igual a 20,0 J/K.
Respuesta
S ser la misma ya que es una funcin de estado.
,
2 2
2 2
2 2
2 2
=
2
2
1
2
= 0
2
1
TMC
Fisicoqumica II
UNICYT Pgina 10 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 10 Atkins Ej. 4.5(a)
Cuando el benceno se congela a 5.5C su densidad cambia desde 0.879g/cm3 a
0.891 g/cm3. Su entalpa de fusin es 10.59kJ/mol.
Estime el punto de congelacin a 1000 atm.
M
benceno
78 g/gmol
Delta H= 10590 J/mol
T1 278.15 K
T2 T2
P1 1 at 1.01E+05 Pa/at 101333 Pa
P2 1000 at 101333 Pa/at 1.0E+08 Pa
VL 1.1377 cm3/g
VS 1.1223 cm3/g
VL-VS 0.01532 cm3/g 1.0E-06 m3/cm3 78 g/mol
VL-VS 1.1951E-06 m3/mol
P2-P1 1.0E+08 Pa
ln(T2/T1) 1.1E-02
T2/T1 1.01149
T2= 281.3 K
T2= 8.2 C
2
1
=
2
1
=
2
1
2
1
=
2
1
1
=
TMC
Fisicoqumica II
UNICYT Pgina 11 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 11 Atkins E4.10a
Qu porcentaje de la entalpa de evaporacin del agua se usa en expandir
el vapor de agua?
100C
Delta H 2,257 kJ/kg 2,257,060 J/kg
V
l
0.00104 m3/kg
V
v
1.6729 m3/kg
P 101,333 Pa
El trabajo PV es PV 169,414 N/m2*m3/kg=Nm/kg=J/kg
%usado= 7.5%
Problema 12 Atkins P 4.8
La presin de vapor, p, del cido ntrico cambia con la temperatura como sigue:
/C 0 20 40 50 70 80
p/kPa 1.92 6.38 17.7 27.7 62.3 89.3
/C 90 100
p/kPa 124.9 170.9
Cual es:
El punto de ebullicin normal
La entalpa de vaporizacin del cido
Graficamos lnp vs 1/T
T(K) 273.15 293.15 313.15 323.15 343.15 353.15 363.15 373.15
p(Pa) 1920 6380 17700 27700 62300 89300 124900 170900
1/T 0.0037 0.0034 0.0032 0.0031 0.0029 0.0028 0.0028 0.0027
lnp 7.5601 8.7609 9.7813 10.2292 11.0397 11.3998 11.7353 12.0488
1/T 0.0027 0.0028 0.0028 0.0029 0.0031 0.0032 0.0034 0.0037
lnp 12.0488 11.7353 11.3998 11.0397 10.2292 9.7813 8.7609 7.5601
TMC
Fisicoqumica II
UNICYT Pgina 12 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Pendiente de la recta es
R= 8.314334 J/molK
m= -4569.7
Hvl 37994.0121 J/mol
Para Psat= 170800 Pa 101333 Pa lnPsat n 11.526
Tsat 373.15 K
lnP0sat 12.0482486 1/T= 0.002794
1/T0 0.00267989 T= 357.9 K
84.7 C
y = -4569.7x + 24.337
R = 0.9996
0.0000
5.0000
10.0000
15.0000
20.0000
25.0000
0.0000 0.0010 0.0020 0.0030 0.0040
L
n
d
e
l
a
p
r
e
s
n
Inverso temperatura saturacin, 1/T (1/K)
1/T
1/T
Linear (1/T)
0
1
=
0
TMC
Fisicoqumica II
UNICYT Pgina 13 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 13 Atkins P4.9
La presin de vapor de la cetona carvona (M=150.2g/gmol), un componente de la
esencia de menta, es la siguiente:
/C 57.4 100.4 133 157.3 203.5 227.5
p/Torr 1 10 40 100 400 760
http://www.chemicalbook.com/ProductMSDSDetailCB1733358_EN.htm
Cual es para la cetona carvona: Boiling point 227 C
El punto normal de ebullicin Heat of vaporization 46.7 kJ/mol
La entalpa de vaporizacin
Este problema es similar al anterior:
T/K 330.55 373.55 406.15 430.45 476.65 500.65
P/pa 133 1333 5333 13332 53328 101323
1/T 0.003025 0.002677 0.002462 0.002323 0.002098 0.001997
ln(P) 4.89 7.20 8.58 9.50 10.88 11.53
1/T 0.001997 0.002098 0.002323 0.002462 0.002677 0.003025
ln(P) 11.5 10.9 9.5 8.6 7.2 4.9
La pendiente de la recta corresponde a
=
0
y = -6446.6x + 24.432
R = 0.9998
0.0
2.0
4.0
6.0
8.0
10.0
12.0
14.0
0.000 0.001 0.001 0.002 0.002 0.003 0.003 0.004
ln(P)
TMC
Fisicoqumica II
UNICYT Pgina 14 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
R= 8.31434 J/gmol P
normal
101330 Pa lnP 11.526
H
vl
= 53599.22424 J/gmol T ebullicin 499.5 K 226.4 C
Wikipedia 231 C
Problema 14 Atkins Ej 5.4(a)
Prediga la presin parcial de vapor del HCl sobre su solucin lquida en tetracloruro de
germanio de molalidad 0.01mol/kg basado en los datos tabulados.
x
HCl
0.005 0.012 0.019
p
HCl
/kPa 32 76.9 121.8
M
Ge
72.64 g/mol M
GeCl4
214.44
M
Cl
35.45 g/mol
BC: 1 mol de solucin
x
HCl
0.005 0.012 0.019
x
GeCl4
0.995 0.988 0.981
n
HCl
0.005 0.012 0.019
n
GeCl4
0.995 0.988 0.981
m
GeCl4
(kg) 0.2134 0.2119 0.2104
m
HCl
0.0234 0.0566 0.0903
K
mHCl
1351.8 kPa
si m= 0.01 Molal
P
HCl
= m
HCl
*K
mHCl
= 13.518 kPa 13518 Pa
y = 1351.8x
R = 0.9999
0
20
40
60
80
100
120
140
0.0000 0.0100 0.0200 0.0300 0.0400 0.0500 0.0600 0.0700 0.0800 0.0900 0.1000
P
r
e
s
i
n
d
e
v
a
p
o
r
H
C
l
(
k
P
a
)
Molalidad HCl (mol/kg solvente)
HCl
HCl
Linear (HCl)
TMC
Fisicoqumica II
UNICYT Pgina 15 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 15 Atkins Ej 5.12(a)
Una planta casera de carbonatacin de agua funciona suministrando dixido de carbono
a 5.0 atm. Estime la concentracin molar de agua de soda que produce.
Para el CO2 la constante de Henry es 3010000 Pa*mol/kg
La presin parcial de CO2 en la fase gaseosa es:
5 at 101330 Pa/at 506650 Pa
La constante de Henry es: 3010000 Pa*mol/kg
mCO2= 0.17 mol/kg agua
MCO2 44 7.4 g/kg agua
Problema 16 Atkins P5.4
Las densidades de soluciones acuosas de sulfato de cobre (II) a 20C fueron medidas
como se muestra ms abajo.
Determine y grafique el volumen parcial molar de CuSO4 en el rango de mediciones.
5 10 15 20
1.051 1.107 1.167 1.23
Donde m es la cantidad de CuSO4 disuelta en 100 g de solucin.
Masa atmica
Cu 63.54
S 32.06
O 16
H 1.01
CuSO
4
159.6
H
2
O 18.02
5 10 15 20
1.051 1.107 1.167 1.23
m
(H2O)
/g 95 90 85 80
n
CuSO4
/gmol 0.03133 0.062657 0.09398496 0.1253
m
CuSO4
/(mol/kg) 0.330 0.696 1.106 1.566
BC: 1 kg solvente Volumen sol(ml) 1001.55 1003.714 1008.11533 1016.3
m(CuSO
4
)/g
/(g cm
3
)
m(CuSO
4
)/g
/(g cm
3
)
TMC
Fisicoqumica II
UNICYT Pgina 16 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
VCuSO4 (cm3/gmol) 2.913 8.207 14.124 20.780
y = 7.2240x
2
- 1.8511x + 1,001.4108
R = 0.9999
1000
1002
1004
1006
1008
1010
1012
1014
1016
1018
0.000 0.200 0.400 0.600 0.800 1.000 1.200 1.400 1.600 1.800
V
o
l
u
m
e
n
d
e
s
o
l
u
c
i
n
(
m
l
)
n CuSO4 (gmol)
= 7.2240
2
1.8511 +1001.4
,,
= 14.4480 1.8511
TMC
Fisicoqumica II
UNICYT Pgina 17 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 1 Levine P9.25
Problema 6 Tarea 2
Sea V el volumen de una disolucin acuosa de NaCl a 25 C y 1 atm que contiene 1000 g de agua y n
B
moles de NaCl. Se puede encontrar la siguiente frmula emprica que reproduce correctamente los
datos experimentales:
V = a + bn
B
+ cn
B
3/2
+ kn
B
2
cuando n
A
M
A
= 1 kg
a = 1002,96 cm3, b = 16,6253 cm3/mol, c = 1,7738 cm3/mol3/2, k = 0,1194 cm3/mol2
(a) Demuestre que el volumen molar parcial V
B
del NaCl es
V
B
= b + (3c/2)n
B
1/2
+ 2kn
B
cuando n
A
M
A
= 1 kg
Por definicin el volumen parcial molar es:
Luego el volumen parcial molar del soluto B, Na Cl, en agua ser:
La expresin para V nos da el volumen de una solucin de NaCl para una cantidad determinada de H2O.
Por lo tanto al derivarla respecto de los moles de NaCl obtendremos el volumen molar parcial del
NaCl para esa cantidad determinada de H2O.
(b) Calcule V
NaCl
para una disolucin con molalidad de
NaCl mB = 1,0000 mol/kg.
a= 1002.96 cm3
b= 16.6253 cm3/mol
c= 1.7738 cm3/mol
(3/2)
k= 0.1194 cm3/mol
2
,,
,,
=
+
3
2
= 1000
= +
3
2
1
2
+2
= 1
TMC
Fisicoqumica II
UNICYT Pgina 1 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Para una molalidad de 1.0000mol/kg de agua, se tiene n
NaCl
=1 mol y N
A
M
A
=1000g
19.5248 cm3/gmol
(c) Si V
B
=16.6 cm3/gmol, demuestre que el volumen molar parcial
del agua en la disolucin es:
V
A
= (M
A
/ 1000 g ) ( a 1/2cn
B
3/2
kn
B
2
) cuando n
A
M
A
= 1 kg
Dado que:
Para 1000g de A, nA ser
Luego
=
=
= +
3
2
= +
3
2
1
2
+ 2
+
3
2
3
2
+2
=
1
2
3
2
=
1
2
3
2
=
1000
1000
1
2
3
2
2
TMC
Fisicoqumica II
UNICYT Pgina 2 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
(d ) Demuestre que los resultados de los apartados (a) y (c) se pueden
escribir en la forma:
V
B
= b + (3c/2)(m
B
kg)
1/2
+ 2km
B
kg
V
A
= (M
A
/1000 g)(a 1/2cm
B
3/2
kg
3/2
- km
B
2
kg
2
)
Dado que V
A
, V
B
y m
B
son magnitudes intensivas, no es necesario especificar
nA en estas ecuaciones.
Por definicin de molalidad:
Entonces
Reemplazamos n
B
por m
B
kg en las expresiones anteriores y se tiene el resultado.
(e) Calcule V
H2O
para una disolucin con m
B
= 1,0000 moles/kg.
V
A
= (M
A
/1000 g)(a 1/2cm
B
3/2
kg
3/2
- km
B
2
kg
2
)
VA= 18.05 cm3/mol M
A
= 18.01534
H 1.00797
O 15.9994
( f ) Calcule V
NaCl
.
El volumen parcial molar a dilucin infinita del cloruro de sodio lo podemos calcular
tomando el lmite de VB cuando nB tiende a cero.
b= 16.6253 cm3/mol
1 =
lim
= lim
0
+
3
2
1
2
+2
=
TMC
Fisicoqumica II
UNICYT Pgina 3 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 2 Atkins P5.13
Chen y Lee estudiaron el equilibrio lquido vapor de ciclohexanol con varios gases a
presiones elevadas (J.-T. Chen and M.-J. Lee, J. Chem. Eng. Data 41, 339 (1996)).
Entre sus datos estn las siguientes mediciones de las fraccin molar de ciclohexanol en
la fase vapor (y) y en la fase lquida (x) a 393.15K en funcin de la presin.
p /bar 10 20 30 40 60 80
y
cyc
0.0267 0.0149 0.0112 0.00947 0.00835 0.00921
x
cyc
0.9741 0.9464 0.9204 0.892 0.836 0.773
Determine la constante de Henry del CO2 en ciclohexanol y calcule el coeficiente de
actividad del CO2.
La ley de Henry nos dice que la presin parcial de vapor de un soluto es igual a la fraccin
molar en el lquido multiplicada por la constante de Henry.
Para la fase gaseosa podemos usar la ley de Dalton de las presiones parciales
Luego
p/bar 10 20 30 40 60 80
y
CO2
0.9733 0.9851 0.9888 0.9905 0.99165 0.99079
x
CO2
0.0259 0.0536 0.0796 0.108 0.164 0.227
y
CO2
P 9.733 19.702 29.664 39.621 59.499 79.263
2
= 1
2
= 1
y = 357.1013x
R = 0.9978
y = 368.9418x
R = 0.9996
0
10
20
30
40
50
60
70
80
90
0 0.05 0.1 0.15 0.2 0.25
P
r
e
s
i
n
p
a
r
c
i
a
l
d
e
C
O
2
(
b
a
r
)
Fraccin molar de CO2 en fase lquida
TMC
Fisicoqumica II
UNICYT Pgina 4 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
En este caso la constante de Henry sobre todo el rango de presiones es 357bar.
Si consideramos el rango bajo de presin, hasta 40 bar, la constante es 369 bar.
Asumiendo KB= 357 bar
P
T
10 20 30 40 60 80
y
B
0.9733 0.9851 0.9888 0.99053 0.99165 0.9908
x
B
0.0259 0.0536 0.0796 0.108 0.164 0.227
B
1.0526 1.0296 1.0439 1.0276 1.0162 0.9781
=
TMC
Fisicoqumica II
UNICYT Pgina 5 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 3 Atkins P5.15
La energa de Gibbs de exceso de soluciones de metilciclohexano (MCH) y
tetrahidrofurano (THF) a 303.15K se expresa como:
en donde x es la fraccin molar de MCH. Calcule la energa de Gibbs de una solucin
de 1.00 mol de MCH y 3.00 moles de THF.
n
i
x
i
nMCH 1 0.25
nTHF 3 0.75
nTOT 4 1
R= 8.31434 J/molK
T= 303.15 K
G
E
molar= 257.2 J/mol
mez
G *= -5669 J
mez
G = -4640 J
= (1 ) 0.4857 0.1077 2 1 +0.0191 2 1
2
TMC
Fisicoqumica II
UNICYT Pgina 6 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 4 Atkins P5.30
A 300K las presiones parciales de vapor de HCl en GeCl4 lquido sonlas siguientes
x
HCl
0.005 0.012 0.019
P
HCl
kPa 32 76.9 121.8
Demuestre que la solucin cumple con la ley de Henry en ese rango de fraccin molar y
calcule el valor de la constante de Henry.
Si el sistema cumple con la Ley de Henry, entonces se cumple que:
siendo B el HCl.
Luego, graficando la presin parcial del HCl versus su fraccin molar debiramos
encontrar una recta cuya pendiente es la constante de Henry.
La recta de regresin tiene un coeficiente lineal de correlacin de 1.0000 y pasa
prcticamente por el origen. La pendiente de la recta es 6414kPa.
y = 6,414.2857x - 0.0714
R = 1.0000
0
20
40
60
80
100
120
140
0 0.005 0.01 0.015 0.02
P
r
e
s
i
n
p
a
r
c
i
a
l
d
e
v
a
p
o
r
d
e
H
C
l
(
P
a
)
Fraccin molar de HCl
Constante de Henry para HCl en GeCl4
TMC
Fisicoqumica II
UNICYT Pgina 7 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 5 Levine P 9.24
Problema 1 Tarea 2
Las densidades del agua y del metanol a 25C y 1 atm son 0.99705 y 0.78706 g/cm
3
repectivamente. Algunos datos de
mez
V frente a x
H2O
para soluciones de estos dos
compuestos, a 25C y 1 at son:
-0.34 -0.6 -0.8 -0.945 -1.01 -0.98
0.1 0.2 0.3 0.4 0.5 0.6
-0.85 -0.615 -0.31
0.7 0.8 0.9
Determine los volmenes molares parciales a: x
H2O
: 0
0.4
0.6
Resuelto en taller 6.1
Problema 6 Levine P9.35
Problema 2 Tarea 2
Calcule
mez
G,
mez
H,
mez
V y
mez
S para el proceso de mezclar 100g de benceno
con 100g de tolueno a 20C. Suponga una disolucin ideal.
Solucin Compuesto Frmula M n x
Benceno C6H6 78 1.2821 0.5412
Para una solucin ideal: Tolueno C6H5(CH3)92 1.0870 0.4588
Mezcla 2.3690 1.0000
R= 8.31434 J/molK
T= 20 C 278 K
mez
G*= -3776.871821 J
mez
S*= 13.6 J/K
mez
H*=
mez
G*+T*
mez
S*= 0
De la sesin 3 tenemos:
mez
V*= 0
mezV (cm3/mol)
xH2O
mezV (cm3/mol)
xH2O
,
=
,
=
,
=
,
TMC
Fisicoqumica II
UNICYT Pgina 8 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 7
Problema 3 Tarea 2 Levine P4.8
Obtenga a partir de la siguiente ecuacin:
la expresin:
para un sistema cerrado de una fase con trabajo P-V solamente, en equilibrio trmico
y mecnico.
Esta expresin proporciona dq durante una reaccin qumica.
Como la reaccin es irreversible, dq TdS.
Reemplazando
Llegamos a:
Problema 8
Problema 4 Tarea 2 Levine problema 4.42
Explique por qu la condicin de igualdad de potenciales qumicos para el hielo en
equilibrio con el agua lquida a 0C y 1 at es equivalente a G=0 para H
2
O
(s)
H
2
O
(l)
.
La condicin general para el cambio de energa de Gibbs a P y T constante es:
Para el sistema hielo-agua
En el caso del sistema hielo-agua:
Adems
Luego
= +
= +
= =
= +
= +
,
=
=1
=
0
,
=
2
+
2
=
2
=
2
,
=
2
+
2
=
2
TMC
Fisicoqumica II
UNICYT Pgina 9 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Integrando entre los estados 1 y 2
Problema 9
Problema 5 Tarea 2 Levine P 4.56
Cuando 3.0 moles de un determinado gas se calientan reversiblemente de 275 K y 1 bar
a 375 K y 1 bar, S es 20.0 J/K. Indique si cuando 3,0 moles de dicho gas se calientan
irreversiblemente de 275 K y 1 bar a 375 K y 1 bar, S ser mayor, menor o igual a 20,0 J/K.
Respuesta
S ser la misma ya que es una funcin de estado.
,
2 2
2 2
2 2
2 2
=
2
2
1
2
= 0
2
1
TMC
Fisicoqumica II
UNICYT Pgina 10 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 10 Atkins Ej. 4.5(a)
Cuando el benceno se congela a 5.5C su densidad cambia desde 0.879g/cm3 a
0.891 g/cm3. Su entalpa de fusin es 10.59kJ/mol.
Estime el punto de congelacin a 1000 atm.
M
benceno
78 g/gmol
Delta H= 10590 J/mol
T1 278.15 K
T2 T2
P1 1 at 1.01E+05 Pa/at 101333 Pa
P2 1000 at 101333 Pa/at 1.0E+08 Pa
VL 1.1377 cm3/g
VS 1.1223 cm3/g
VL-VS 0.01532 cm3/g 1.0E-06 m3/cm3 78 g/mol
VL-VS 1.1951E-06 m3/mol
P2-P1 1.0E+08 Pa
ln(T2/T1) 1.1E-02
T2/T1 1.01149
T2= 281.3 K
T2= 8.2 C
2
1
=
2
1
=
2
1
2
1
=
2
1
1
=
TMC
Fisicoqumica II
UNICYT Pgina 11 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 11 Atkins E4.10a
Qu porcentaje de la entalpa de evaporacin del agua se usa en expandir
el vapor de agua?
100C
Delta H 2,257 kJ/kg 2,257,060 J/kg
V
l
0.00104 m3/kg
V
v
1.6729 m3/kg
P 101,333 Pa
El trabajo PV es PV 169,414 N/m2*m3/kg=Nm/kg=J/kg
%usado= 7.5%
Problema 12 Atkins P 4.8
La presin de vapor, p, del cido ntrico cambia con la temperatura como sigue:
/C 0 20 40 50 70 80
p/kPa 1.92 6.38 17.7 27.7 62.3 89.3
/C 90 100
p/kPa 124.9 170.9
Cual es:
El punto de ebullicin normal
La entalpa de vaporizacin del cido
Graficamos lnp vs 1/T
T(K) 273.15 293.15 313.15 323.15 343.15 353.15 363.15 373.15
p(Pa) 1920 6380 17700 27700 62300 89300 124900 170900
1/T 0.0037 0.0034 0.0032 0.0031 0.0029 0.0028 0.0028 0.0027
lnp 7.5601 8.7609 9.7813 10.2292 11.0397 11.3998 11.7353 12.0488
1/T 0.0027 0.0028 0.0028 0.0029 0.0031 0.0032 0.0034 0.0037
lnp 12.0488 11.7353 11.3998 11.0397 10.2292 9.7813 8.7609 7.5601
TMC
Fisicoqumica II
UNICYT Pgina 12 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Pendiente de la recta es
R= 8.314334 J/molK
m= -4569.7
Hvl 37994.0121 J/mol
Para Psat= 170800 Pa 101333 Pa lnPsat n 11.526
Tsat 373.15 K
lnP0sat 12.0482486 1/T= 0.002794
1/T0 0.00267989 T= 357.9 K
84.7 C
y = -4569.7x + 24.337
R = 0.9996
0.0000
5.0000
10.0000
15.0000
20.0000
25.0000
0.0000 0.0010 0.0020 0.0030 0.0040
L
n
d
e
l
a
p
r
e
s
n
Inverso temperatura saturacin, 1/T (1/K)
1/T
1/T
Linear (1/T)
0
1
=
0
TMC
Fisicoqumica II
UNICYT Pgina 13 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 13 Atkins P4.9
La presin de vapor de la cetona carvona (M=150.2g/gmol), un componente de la
esencia de menta, es la siguiente:
/C 57.4 100.4 133 157.3 203.5 227.5
p/Torr 1 10 40 100 400 760
http://www.chemicalbook.com/ProductMSDSDetailCB1733358_EN.htm
Cual es para la cetona carvona: Boiling point 227 C
El punto normal de ebullicin Heat of vaporization 46.7 kJ/mol
La entalpa de vaporizacin
Este problema es similar al anterior:
T/K 330.55 373.55 406.15 430.45 476.65 500.65
P/pa 133 1333 5333 13332 53328 101323
1/T 0.003025 0.002677 0.002462 0.002323 0.002098 0.001997
ln(P) 4.89 7.20 8.58 9.50 10.88 11.53
1/T 0.001997 0.002098 0.002323 0.002462 0.002677 0.003025
ln(P) 11.5 10.9 9.5 8.6 7.2 4.9
La pendiente de la recta corresponde a
=
0
y = -6446.6x + 24.432
R = 0.9998
0.0
2.0
4.0
6.0
8.0
10.0
12.0
14.0
0.000 0.001 0.001 0.002 0.002 0.003 0.003 0.004
ln(P)
TMC
Fisicoqumica II
UNICYT Pgina 14 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
R= 8.31434 J/gmol P
normal
101330 Pa lnP 11.526
H
vl
= 53599.22424 J/gmol T ebullicin 499.5 K 226.4 C
Wikipedia 231 C
Problema 14 Atkins Ej 5.4(a)
Prediga la presin parcial de vapor del HCl sobre su solucin lquida en tetracloruro de
germanio de molalidad 0.01mol/kg basado en los datos tabulados.
x
HCl
0.005 0.012 0.019
p
HCl
/kPa 32 76.9 121.8
M
Ge
72.64 g/mol M
GeCl4
214.44
M
Cl
35.45 g/mol
BC: 1 mol de solucin
x
HCl
0.005 0.012 0.019
x
GeCl4
0.995 0.988 0.981
n
HCl
0.005 0.012 0.019
n
GeCl4
0.995 0.988 0.981
m
GeCl4
(kg) 0.2134 0.2119 0.2104
m
HCl
0.0234 0.0566 0.0903
K
mHCl
1351.8 kPa
si m= 0.01 Molal
P
HCl
= m
HCl
*K
mHCl
= 13.518 kPa 13518 Pa
y = 1351.8x
R = 0.9999
0
20
40
60
80
100
120
140
0.0000 0.0100 0.0200 0.0300 0.0400 0.0500 0.0600 0.0700 0.0800 0.0900 0.1000
P
r
e
s
i
n
d
e
v
a
p
o
r
H
C
l
(
k
P
a
)
Molalidad HCl (mol/kg solvente)
HCl
HCl
Linear (HCl)
TMC
Fisicoqumica II
UNICYT Pgina 15 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
Problema 15 Atkins Ej 5.12(a)
Una planta casera de carbonatacin de agua funciona suministrando dixido de carbono
a 5.0 atm. Estime la concentracin molar de agua de soda que produce.
Para el CO2 la constante de Henry es 3010000 Pa*mol/kg
La presin parcial de CO2 en la fase gaseosa es:
5 at 101330 Pa/at 506650 Pa
La constante de Henry es: 3010000 Pa*mol/kg
mCO2= 0.17 mol/kg agua
MCO2 44 7.4 g/kg agua
Problema 16 Atkins P5.4
Las densidades de soluciones acuosas de sulfato de cobre (II) a 20C fueron medidas
como se muestra ms abajo.
Determine y grafique el volumen parcial molar de CuSO4 en el rango de mediciones.
5 10 15 20
1.051 1.107 1.167 1.23
Donde m es la cantidad de CuSO4 disuelta en 100 g de solucin.
Masa atmica
Cu 63.54
S 32.06
O 16
H 1.01
CuSO
4
159.6
H
2
O 18.02
5 10 15 20
1.051 1.107 1.167 1.23
m
(H2O)
/g 95 90 85 80
n
CuSO4
/gmol 0.03133 0.062657 0.09398496 0.1253
m
CuSO4
/(mol/kg) 0.330 0.696 1.106 1.566
BC: 1 kg solvente Volumen sol(ml) 1001.55 1003.714 1008.11533 1016.3
m(CuSO
4
)/g
/(g cm
3
)
m(CuSO
4
)/g
/(g cm
3
)
TMC
Fisicoqumica II
UNICYT Pgina 16 de 17
Fisicoqumica II Taller 7 19 de Mayo de 2014
VCuSO4 (cm3/gmol) 2.913 8.207 14.124 20.780
y = 7.2240x
2
- 1.8511x + 1,001.4108
R = 0.9999
1000
1002
1004
1006
1008
1010
1012
1014
1016
1018
0.000 0.200 0.400 0.600 0.800 1.000 1.200 1.400 1.600 1.800
V
o
l
u
m
e
n
d
e
s
o
l
u
c
i
n
(
m
l
)
n CuSO4 (gmol)
= 7.2240
2
1.8511 +1001.4
,,
= 14.4480 1.8511
TMC
Fisicoqumica II
UNICYT Pgina 17 de 17
Fisicoqumica II
UNICIT
Taller 8
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
1
PRESIN OSMTICA
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
2
Problema 1
La presin osmtica de una disolucin acuosa
de albmina bovina con
B
= 0,0200 g/cm3 es
6,1 torr a 0 C. Estime el peso molecular de
esta protena. Explique por qu su respuesta
es slo una estimacin.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
3
Problema 2
Para una muestra de un poliaminocido sinttico en
agua a 30 C (densidad 0,996 g/cm3), la determinacin
de la presin osmtica condujo a los siguientes valores
de la diferencia de altura h entre los lquidos en los
tubos capilares de la figura.
Transforme las medidas de alturas en presiones y
calcule el peso molecular promedio en nmero del
polmero.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
4
h/cm 2.18 3.58 6.13 9.22
B
/(g/dm
3
) 3.71 5.56 8.34 11.12
Problema 2
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
5
ACTIVIDAD
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
6
Problema 3
Al medir el equilibrio entre las fases lquidas y
gaseosa de una solucin de acetona (A) y metano
(M) a 57,2C y a 1.00 atm, se encontr que x
A
=
0.400 cuando y
A
=0,516. Calcule las actividades y
los coeficientes de actividad de ambos
componentes en esta solucin basndose en la
ley de Raoult . Las presiones de vapor de los
componentes puros a esta temperatura son: p
A
*
=105 kPa y p
M
*=73.5 kPa. (x
A
es la fraccin molar
en el lquido e y
A
es la fraccin molar en el vapor.)
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
7
Problema 4
A continuacin se indican los coeficientes de
actividad medio de soluciones acuosas de
NaCl a 25C. Verifique que cumplen la ley
lmite de Debye-Hckel y que con la ley
extendida se obtiene mayor coincidencia.
Toms Muzzio, Fisicoqumica 2, 1er
Semestre 2014
8
b/(mmol/kg) 1 2 5 10 20
0.9649 0.9519 0.9275 0.9024 0.8712
Problema 1
La presin osmtica de una disolucin acuosa de albmina bovina con
B
= 0,0200 g/cm3 es 6,1 torr
a 0 C. Estime el peso molecular de esta protena. Explique por qu su respuesta es slo una
estimacin.
Solucin
La ecuacin de Van't Hoff es:
= 6.1 torr 133.2 Pa/torr 812.52 Pa
B
= 0.02 g/cm3 0.001 kg/g 1.00E+06 cm3/m3 2.00E+01 kg/m3
c
B
=B/M
B
R= 8314.34 J/kg-molK
T= 0 C 273.15 K
M
B
= 55902 kg/kg-mol
La solucin no es exactamente una solucin diluda ideal.
=
1 = 1
812.52 =
20
8314.34 273.15
Problema 2
Para una muestra de un poliaminocido sinttico en agua a 30 C (densidad 0,996 g/cm3), la
determinacin de la presin osmtica condujo a los siguientes valores de la diferencia de altura h
entre los lquidos en los tubos capilares de la figura.
h/cm 2.18 3.58 6.13 9.22
B
/(g/dm
3
) 3.71 5.56 8.34 11.12
B
/(kg/m
3
) 3.71 5.56 8.34 11.12
Transforme las medidas de alturas en presiones y calcule el peso molecular promedio en nmero
del polmero.
Solucin
Vamos a asumir que la densidad de la solucin es constante en el rango de concentraciones.
sol
= 0.996 g/cm3 1.0E-03 kg/g 1.00E+06 cm3/m3 9.96E+02 kg/m3
g= 9.81 m/s2
T= 30 C 303.15 K
De la ecuacin de Van't Hoff
h/cm h/m
sol
(kg/m3) (Pa) T (K) R (J/kg-molK) c
B
(kgmol/m
3
)
B
/(kg/m
3
) M
B
(kg/kgmol)
2.18 0.0218 996 213 303.15 8314.34 8.4508E-05 3.71 4.3901E+04
3.58 0.0358 996 350 303.15 8314.34 1.3878E-04 5.56 4.0063E+04
6.13 0.0613 996 599 303.15 8314.34 2.3763E-04 8.34 3.5096E+04
9.22 0.0922 996 901 303.15 8314.34 3.5742E-04 11.12 3.1112E+04
La situacin se aproximar a la ideal en la solucin infinitamente diluda.
Para concentracin cero, el valor de la masa molecular es 52907.
y = 63.04x
2
- 2,661.05x + 52,907.16
R = 1.00
0.00E+00
5.00E+03
1.00E+04
1.50E+04
2.00E+04
2.50E+04
3.00E+04
3.50E+04
4.00E+04
4.50E+04
5.00E+04
0.00 2.00 4.00 6.00 8.00 10.00 12.00
M
a
s
a
m
o
l
e
c
u
l
a
r
;
M
B
(
k
g
/
k
g
m
o
l
)
Concentracin ;
B
/(kg/m3)
MB(kg/kgmol)
MB(kg/kgmol)
Poly. (MB(kg/kgmol))
Problema 3
Al medir el equilibrio entre las fases lquidas y gaseosa de una solucin de acetona (A) y metano (M) a 57,2C
y a 1.00 atm, se encontr que x
A
= 0.400 cuando y
A
=0.516. Calcule las actividades y los coeficientes de actividad
de ambos componentes en esta solucin basndose en la ley de Raoult . Las presiones de vapor de los
componentes puros a esta temperatura son: p
A
* =105 kPa y p
M
*=73.5 kPa.
(x
A
es la fraccin molar en el lquido e y
A
es la fraccin molar en el vapor.)
Solucin
La Ley de Raoult indica que la presin parcial de un componente en una solucin es igual a su presin de vapor
como componente puro multiplicada por su fraccin molar.
Por otro lado la Ley de Dalton me indica que la presin parcial en el vapor es igual a la fraccin molar por la
presin total.
Component x y p* (kPa) p a=p/p*
Acetona 0.400 0.516 105 5.229E+04 0.498 1.244911
Metano 0.600 0.484 73.5 4.904E+04 0.667 1.112102
Total 1.000 1.000
Ptot= 1 at 1.0133E+05 Pa
= 1.0133 10
5
Problema 4
A continuacin se indican los coeficientes de actividad medio de soluciones acuosas de NaCl a 25C.
Verifique que cumplen la ley lmite de Debye-Hckel y que con la ley extendida se obtiene mayor
coincidencia.
b/(mmol/kg) 1 2 5 10 20
b/(mol/kg) 0.001 0.002 0.005 0.01 0.02
0.9649 0.9519 0.9275 0.9024 0.8712
Solucin
Ley lmite de Debye Hckel
Z
+
= 1
Z
-
= 1
A= 0.509
I =
b
0
= 1 mol/kg 1 molal
b/(mmol/kg) 1 2 5 10 20
b/(mol/kg) 0.001 0.002 0.005 0.01 0.02
0.9649 0.9519 0.9275 0.9024 0.8712
log -0.0155 -0.0214 -0.0327 -0.0446 -0.0599
Na
+
0.001 0.002 0.005 0.01 0.02
Cl
-
0.001 0.002 0.005 0.01 0.02
z+ 1
z- 1
I 0.001 0.002 0.005 0.01 0.02
I
0.5
0.031623 0.0447 0.0707 0.1 0.141421356
log -0.0161 -0.023 -0.036 -0.0509 -0.07198347
0.9636 0.9489 0.9205 0.8894 0.8473
Debye Hckel ext -0.0154 -0.0214 -0.0327 -0.0445 -0.0599
log
=
+
1 2
=
1
2
=
+
1
2
1 +
1
2
Ley extendida de Debye Hckel
1) Asumimos que A=0.509
2) Asumimos C=0
3) Estimamos B para un valor de I.
Consideremos el par I= 0.02 I^0.5 0.141421356 7.071068
log = -0.0599
B= 1.4264
-0.0800
-0.0700
-0.0600
-0.0500
-0.0400
-0.0300
-0.0200
-0.0100
0.0000
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16
L
o
g
(Fuerza Inica)^0.5 (I
1/2
)
Experimentales
Calculados
Extendida
=
+
1
2
1 +
1
2
+
0.0599 =
0.509 1 0.1414213
1 + 0.1414213
You might also like
- Análisis financiero sensibilidadDocument6 pagesAnálisis financiero sensibilidadflip-floNo ratings yet
- Practica 5. Entalpia de Fusion.Document6 pagesPractica 5. Entalpia de Fusion.VICTORIA TOLEDONo ratings yet
- Factores de Deserción Escolar TesisDocument77 pagesFactores de Deserción Escolar TesisMaría José Ramírez Palma0% (1)
- Proyecto 2 Diseño Equilibrio Quimico RedoxDocument16 pagesProyecto 2 Diseño Equilibrio Quimico RedoxJose Antonio VazquezNo ratings yet
- Problemas Resueltos Tarea 1 Fisicoquímica II PDFDocument8 pagesProblemas Resueltos Tarea 1 Fisicoquímica II PDFtmuzzio33% (3)
- Pedagogia - Immanuel Kant PDFDocument115 pagesPedagogia - Immanuel Kant PDFRicardo Lindquist100% (3)
- Determinación Espetrofotométrica de Una Constante de EquilibrioDocument8 pagesDeterminación Espetrofotométrica de Una Constante de EquilibrioAlvaro Etcheverry67% (3)
- Termodinámica SistemasDocument543 pagesTermodinámica SistemasDante100% (1)
- La Génesis de Los Valores MoralesDocument9 pagesLa Génesis de Los Valores MoralesFélixFernándezPalacioNo ratings yet
- Kirzner y el papel del empresario como descubridor de oportunidadesDocument9 pagesKirzner y el papel del empresario como descubridor de oportunidadesJuan Saucedo100% (1)
- Método para Determinar Presión de Vapor y Sistemas Gas LíquidoDocument9 pagesMétodo para Determinar Presión de Vapor y Sistemas Gas LíquidoRocio RojasNo ratings yet
- Distribucion de Acido Acetico Entre Agua y BencenoDocument11 pagesDistribucion de Acido Acetico Entre Agua y BencenoValeria TreviñoNo ratings yet
- Practica 3 - Ley de Enfriamiento de NewtonDocument16 pagesPractica 3 - Ley de Enfriamiento de NewtonJonathan AlonsoNo ratings yet
- Determinación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaDocument3 pagesDeterminación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaSebas Soto0% (1)
- Práctica 3 Laboratorio de Equilibrio y CineticaDocument4 pagesPráctica 3 Laboratorio de Equilibrio y CineticaDany PandaNo ratings yet
- Determinación de La Constante de Enfriamiento de Un LiquidoDocument3 pagesDeterminación de La Constante de Enfriamiento de Un LiquidoIgnacio Garcia0% (3)
- Determinación de propiedades físicoquímicasDocument28 pagesDeterminación de propiedades físicoquímicasYanira CParedes100% (1)
- Practica #5 CALOR DE REACCIONDocument7 pagesPractica #5 CALOR DE REACCIONDeymis Albor100% (1)
- Previo 9 Organica 1Document15 pagesPrevio 9 Organica 1Brenda KarenNo ratings yet
- Calor de CombustiónDocument13 pagesCalor de CombustiónSaul HernándezNo ratings yet
- Biografía de Clausius ClapeyrónDocument2 pagesBiografía de Clausius ClapeyrónEnrique MANo ratings yet
- Reporte de Termo Capacidad TermicaDocument8 pagesReporte de Termo Capacidad TermicazettamcNo ratings yet
- Calor de fusión hieloDocument3 pagesCalor de fusión hieloSod Neron0% (2)
- Practica Calor de NeutralizacionDocument3 pagesPractica Calor de NeutralizacionAldair LugoNo ratings yet
- 1er Examen de Termo 1 A 5 PDFDocument3 pages1er Examen de Termo 1 A 5 PDFjimenaNo ratings yet
- EquilibrioionicoDocument11 pagesEquilibrioionicoElizabeth BecerraNo ratings yet
- EjerciciosDocument1 pageEjerciciosArturo ValdelamarNo ratings yet
- Informe II. Convección Libre - ForzadaDocument8 pagesInforme II. Convección Libre - ForzadaJerónimo García ZapataNo ratings yet
- Práctica 1. Determinación de La Capacidad CaloríficaDocument17 pagesPráctica 1. Determinación de La Capacidad CaloríficaKarina Gabriel FloresNo ratings yet
- Uso Del Multimetro01Document11 pagesUso Del Multimetro01Gaby Cortés 7u7No ratings yet
- Propiedades coligativas: Terbutanol y BenzofenonaDocument6 pagesPropiedades coligativas: Terbutanol y BenzofenonaVICTORIA TOLEDONo ratings yet
- Entropia de ProcesosDocument9 pagesEntropia de ProcesosAlejandra100% (1)
- Lectura 11Document20 pagesLectura 11Gonzalo A. NazalNo ratings yet
- Mezcla EutecticaDocument25 pagesMezcla EutecticaTania Mireya VillarroelNo ratings yet
- Aplicación Del Lenguaje TermodinámicoDocument4 pagesAplicación Del Lenguaje TermodinámicoSara Jiménez GómezNo ratings yet
- PRACTICA 4 Campo ElectricoDocument14 pagesPRACTICA 4 Campo Electricoricardo6h6hlenNo ratings yet
- Reporte de Practica 1Document4 pagesReporte de Practica 1Jonathan Marquez100% (1)
- Reporte Q.A 1.2Document10 pagesReporte Q.A 1.2MisaelNo ratings yet
- Capacidad Calorífica de Un CalorímetroDocument6 pagesCapacidad Calorífica de Un Calorímetroソーダ エドゥアルドNo ratings yet
- Taller1 1 2018Document7 pagesTaller1 1 2018Ana M. Galan PérezNo ratings yet
- Preinforme Presión de VaporDocument6 pagesPreinforme Presión de VaporErika FonsecaNo ratings yet
- Reporte 8 Equilibrio QuímicoDocument20 pagesReporte 8 Equilibrio QuímicoJose Antonio VazquezNo ratings yet
- PRÁCTICA 9 Isomería I.Q. Fes CuautitlanDocument5 pagesPRÁCTICA 9 Isomería I.Q. Fes CuautitlanJose Emmanuel ChemaNo ratings yet
- Esquema 4. Estudio Del EquilibrioDocument8 pagesEsquema 4. Estudio Del EquilibrioCarlos Canache RamirezNo ratings yet
- Tension SuperficialDocument29 pagesTension SuperficialGiancarlo HuertaNo ratings yet
- Practica 6 EyCDocument13 pagesPractica 6 EyCViridiana Guadalupe Alvarez SantinNo ratings yet
- Practica 1. LTEFDocument17 pagesPractica 1. LTEFFernanda ToscanoNo ratings yet
- Caso de Estudio FisicoquímicaDocument14 pagesCaso de Estudio FisicoquímicaAxel Velazquez MoralesNo ratings yet
- Ley de Enfriamiento de NewtonDocument21 pagesLey de Enfriamiento de NewtonMarco antonio Sanchez medinaNo ratings yet
- Tubos y Coraza Lem 1-6Document4 pagesTubos y Coraza Lem 1-6Alejandro Garcia GarciaNo ratings yet
- Informe Fisicoquimica: Sistemas BinariosDocument7 pagesInforme Fisicoquimica: Sistemas BinariosAngel Bryan Ñahuis OrtizNo ratings yet
- Previo Práctica 3Document2 pagesPrevio Práctica 3Citlalli BarajasNo ratings yet
- Reporte Practica Labo 2 Presion de VaporDocument7 pagesReporte Practica Labo 2 Presion de VaporKoKo Torres AndradeNo ratings yet
- Práctica 3 TermoDocument7 pagesPráctica 3 TermoEdgarMartínezNo ratings yet
- Ley de Ohm y ConductimetríaDocument11 pagesLey de Ohm y ConductimetríaHdhfjdodvNo ratings yet
- Practica. Equilibrio QuimicoDocument6 pagesPractica. Equilibrio QuimicoSponja75No ratings yet
- Informe Equilibrio Liquido VaporDocument16 pagesInforme Equilibrio Liquido Vaporluzvid alejo ochoa0% (1)
- Crioscopia InformeDocument32 pagesCrioscopia Informekaherine laderaNo ratings yet
- Practica3 Equilibrio-QuimicoDocument7 pagesPractica3 Equilibrio-QuimicoJocelynNo ratings yet
- APLICACIÓN LENGUAJE TERMODINÁMICODocument3 pagesAPLICACIÓN LENGUAJE TERMODINÁMICOJocelyne Bruselas AuzaNo ratings yet
- Diagrama de Flujo de Práctica 3Document1 pageDiagrama de Flujo de Práctica 3Jomara GonzálezNo ratings yet
- Previo 8Document4 pagesPrevio 8Ximena GonzálezNo ratings yet
- LeyesTermodinámicaLaboratorioDocument8 pagesLeyesTermodinámicaLaboratorioAndrés Ix GalánNo ratings yet
- Practica 4 Efectos Termicos 3 Calor de Fusion Del HieloDocument4 pagesPractica 4 Efectos Termicos 3 Calor de Fusion Del HieloEduardo Lara MagañaNo ratings yet
- Practica 1Document2 pagesPractica 1Alondra Olvera GonzalezNo ratings yet
- Introducción a la FisicoquímicaDocument76 pagesIntroducción a la FisicoquímicaRaul Antonio Hernandez Delgado50% (2)
- Problemas Resueltos FisicoquímicaDocument26 pagesProblemas Resueltos FisicoquímicatmuzzioNo ratings yet
- Problemas Resueltos FisicoquímicaDocument26 pagesProblemas Resueltos FisicoquímicatmuzzioNo ratings yet
- Calores Integrales y Diferenciales de DisoluciónDocument2 pagesCalores Integrales y Diferenciales de DisolucióntmuzzioNo ratings yet
- EEP N° 69 - Diálogo, participación e igualdad en la escuelaDocument7 pagesEEP N° 69 - Diálogo, participación e igualdad en la escuelaKarina CabreraNo ratings yet
- Fundamentación Teórica y Conceptual UNIDAD 1Document4 pagesFundamentación Teórica y Conceptual UNIDAD 1arlacanNo ratings yet
- Resolución de contrato de locación de obra por incumplimientoDocument5 pagesResolución de contrato de locación de obra por incumplimientoheinrichvo100% (1)
- Apunte Completo de SociologiaDocument84 pagesApunte Completo de SociologiaFlorenciaDurán100% (1)
- Que Es La Medicina Basada en Evidencia CientíficaDocument4 pagesQue Es La Medicina Basada en Evidencia Científicanatali venancioNo ratings yet
- Taller Logica MatematicaDocument3 pagesTaller Logica Matematicacarlosjavierguzmanbu100% (1)
- Claudio Martín Viale El Derecho ConstitucionalDocument2 pagesClaudio Martín Viale El Derecho ConstitucionalCarlos VasquezNo ratings yet
- A PortesDocument219 pagesA PortesLuz BareiroNo ratings yet
- Cuestionario 2Document5 pagesCuestionario 2Erick MendezNo ratings yet
- Semana 5 Axiologia en DebateDocument15 pagesSemana 5 Axiologia en DebateRobinho Sullca CerronNo ratings yet
- Modelo de Tesis para AbastecimientoDocument46 pagesModelo de Tesis para AbastecimientoJAZMINNo ratings yet
- Narrativa Docente, Prácticas Escolares y Reconstrucción de La Memoria PedagógicaDocument66 pagesNarrativa Docente, Prácticas Escolares y Reconstrucción de La Memoria Pedagógicasonia_alonso_750% (2)
- TEORÍAS PENA Y CRÍTICAS ZAFFARONIDocument3 pagesTEORÍAS PENA Y CRÍTICAS ZAFFARONIUlises AngelNo ratings yet
- Consultoría clima FEPT UMSADocument53 pagesConsultoría clima FEPT UMSAAlejandro DeckerNo ratings yet
- Comportamiento en el matrimonio cristianoDocument1 pageComportamiento en el matrimonio cristianoSamuel Marcano100% (1)
- Clase Enfoque PsicosocialDocument31 pagesClase Enfoque PsicosocialMariafeguerraNo ratings yet
- Preparador de Clases Primer Periodo Grado 7ºDocument1 pagePreparador de Clases Primer Periodo Grado 7ºJuan Carlos Espinosa MoraNo ratings yet
- Cronologia de La Independencia Del PeruDocument74 pagesCronologia de La Independencia Del PeruESCARABAJO DE ORONo ratings yet
- Interrogantes Acerca Del Conocimiento Geográfico en La Actual Reforma Educativa. Candreva, AnnaDocument13 pagesInterrogantes Acerca Del Conocimiento Geográfico en La Actual Reforma Educativa. Candreva, AnnaBIBHUMANo ratings yet
- Amérikka. Flor o Resurrección.Document889 pagesAmérikka. Flor o Resurrección.Gonzalo Conde EscuredoNo ratings yet
- Pauta GrafemariosDocument8 pagesPauta GrafemariosAna DussarratNo ratings yet
- Lectura Filosofía y SociedadDocument77 pagesLectura Filosofía y SociedadBrayan PabónNo ratings yet
- Derechos Humanos Norberto BobbbioDocument32 pagesDerechos Humanos Norberto BobbbioCIRO ALFONSO CAICEDO CAICEDONo ratings yet
- Arte NaifDocument2 pagesArte NaifJhorman DiazNo ratings yet
- MercantilismoDocument17 pagesMercantilismo12690854No ratings yet