Professional Documents
Culture Documents
Pages From RN 09 02-4
Uploaded by
Silvestre Gonçalves de SouzaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Pages From RN 09 02-4
Uploaded by
Silvestre Gonçalves de SouzaCopyright:
Available Formats
60
ARTIGO
Doenças Mitocondriais
Ibrahim E. Nasseh1
Célia H. Tengan2
Beatriz H. Kiyomoto2
Alberto Alain Gabbai3
RESUMO
As doenças mitocondriais são um capítulo relativamente recente no estudo das doenças humanas e seu entendimento
fisiopatológico necessita de uma abordagem genética de cada paciente. O correto funcionamento das mitocôndrias
depende da interação de dois genomas, o nuclear e o mitocondrial. Nesta revisão oferecemos uma introdução sobre
genética mitocondrial, a atual classificação das doenças mitocondriais, discorrendo brevemente sobre as apresentações
clínicas.
Unitermos: Mitocôndria, citocromo-c oxidase, DNA mitocondrial, doenças mitocondriais.
Introdução em 1988, com os trabalhos de Holt et al.5 e Wallace
et al. 6. Até 1992, apenas 5 mutações haviam sido
A primeira doença mitocondrial foi descrita por
descritas. Em 9 anos de pesquisa, a partir de então
Ernester et al.1, em 1959, sobre um paciente eutiroi-
mais de 100 mutações de ponto diferentes foram
deano que apresentava longo histórico de sintomas
publicadas (128 mutações descritas até abril de 2001)7
relacionados a um estado de permanente hiperme-
e muito mais ainda se espera descobrir com o seqüen-
tabolismo com alterações morfológicas e bioquímicas
ciamento do genoma nuclear humano, pois o correto
da mitocôndria (doença de Luft). Somente na década
funcionamento e a estrutura da mitocôndria depen-
de 1970 é que outras doenças mitocondriais come-
dem da perfeita integridade e interação dos dois
çaram a ser descritas, principalmente seus aspectos
genomas (mitocondrial e nuclear).
bioquímicos. O termo “encefalomiopatia mitocon-
drial” foi introduzido em 1977 por Shapira et al. 2. As mitocôndrias são organelas intracitoplas-
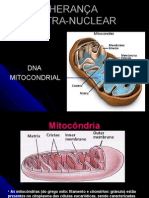
Apesar de o conhecimento de que a mitocôndria máticas envoltas por duas membranas e estão pre-
possui seu próprio DNA (DNAmt) ser antigo3 (1963), sentes na quase totalidade das células eucariontes. A
a caracterização completa da seqüência nucleotídica principal função atribuída à mitocôndria é a de prover
do DNAmt humano só foi desvendada em 1981 por energia à célula. Estima-se que mais de 90% do ATP
Anderson et al. 4. Essa descoberta tornou possível necessário aos diversos propósitos biológicos seja
fazer a ligação entre as alterações bioquímicas, produzido por essa organela. Além disso, estão também
estruturais e histopatológicas das doenças, até então envolvidas com a biossíntese de pirimidinas e do grupo
descritas, com várias mutações do DNAmt. As pri- heme da hemoglobina (por meio de enzimas especí-
meiras descrições de mutações no DNAmt deram-se ficas), bem como com o metabolismo de colesterol e
1
Pós-graduando da Disciplina de Neurologia da Escola Paulista de Medicina – Unifesp.
2
Doutora em Medicina da Disciplina de Neurologia da Escola Paulista de Medicina – Unifesp.
3
Professor Titular e Chefe da Disciplina de Neurologia da Escola Paulista de Medicina – Unifesp.
Rev. Neurociências 9(2): 60-69, 2001
Doenças Mitocondriais 61
neurotransmissores. Têm ainda funções na produção materna; assim, a herança materna é altamente
de radicais livres para propósitos específicos na célula sugestiva de um defeito no DNAmt. Cada mitocôndria
(sinalização celular e processo inflamatório) e na pode conter de 5 a 10 genomas mitocondriais, e cada
detoxicação desses mesmos radicais em outras si- célula, dezenas a centenas de moléculas, dependendo
tuações. do tecido. Assim, quando existe uma mutação no
A produção de energia ocorre devido a um pro- DNAmt, a célula pode apresentar 100% de DNAmt
cesso chamado de fosforilação oxidativa, que se mutado ou 100% de DNAmt normal, condição deno-
baseia no transporte e na utilização de determinados minada de homoplasmia; ou pode apresentar uma
substratos por vários complexos enzimáticos. Os dois mistura dos dois tipos de DNAmt, mutado e normal,
principais substratos oxidados para o fornecimento condição denominada de heteroplasmia. A transmissão
de energia são o piruvato (produto da glicólise) e os do DNAmt mutado ocorre durante a divisão das mito-
ácidos graxos livres. Os sistemas enzimáticos que côndrias, e a proporção de mutante passado para cada
os oxidam são: complexo enzimático piruvato célula filha é aleatória (segregação mitótica). O que
desidrogenase e beta-oxidativo respectivamente, determina se a célula ou o tecido serão afetados são a
sendo o último ainda dependente de várias etapas proporção de mutante e o limiar de cada célula ou
intermediárias em que a carnitina é necessária. A tecido. Assim, geralmente são necessários altos níveis
oxidação desses produtos fornece acetil-CoA para o de DNAmt mutado para que a célula apresente uma
ciclo de Krebs, provendo elétrons livres de alta energia deficiência na sua função. Entretanto, os níveis
necessários para que a célula se torne deficiente (limiar)
que são carreados à cadeia respiratória. Os elétrons
dependem do tipo de tecido e do tipo de mutação. Os
passam, então, por esta cadeia ordenada de moléculas
tecidos que apresentam grande requerimento ener-
e proteínas até seu aceptor final, o oxigênio. Nesse
gético, como o cérebro e os músculos esquelético e
processo, os elétrons vão “perdendo” progressiva-
cardíaco, apresentam um limiar mais baixo quando
mente energia, que por sua vez é “captada” e arma-
comparados com aqueles com menor requerimento
zenada na forma de ATP. Quatro complexos enzi-
energético, como células hematopoiéticas.
máticos são conjuntamente chamados de cadeia
respiratória: Complexo I (NADH-coenzima Q oxir- São necessários cerca de 3.000 genes para fazer
redutase), Complexo II (succinato-ubiquinona uma mitocôndria. Desses, somente 37 são codifi-
oxirredutase), Complexo III (ubiquinona-citocromo-c cados pelo DNAmt; o restante (a maioria) é codi-
oxirredutase), Complexo IV (citocromo-c oxidase- ficado pelo núcleo, sintetizado no citoplasma e
COX), dois transportadores de elétrons móveis, a posteriormente transportado para dentro da mi-
coenzima Q10 (ubiquinona) e o citocromo-c. Um tocôndria. O DNAn é responsável pela síntese de
quinto complexo enzimático completa, então, a proteínas que terão funções diversas na mitocôndria,
fosforilação oxidativa: o Complexo V (ATP sintetase). desde a participação na estrutura da mitocôndria até
o controle da replicação e da transcrição do DNAmt.
As doenças mitocondriais são doenças por defi-
Assim, o funcionamento perfeito da mitocôndria
ciência mitocondrial primária. Já foram descritas várias
depende da interação adequada dos dois genomas.
alterações bioquímicas causadoras dessas doenças8.
As doenças mitocondriais são o resultado de mu-
As doenças mitocondriais mais estudadas e mais
tações herdadas ou espontâneas do DNAmt ou
comuns, em seu conjunto clínico, são as que afetam a
DNAn, levando à função anormal de proteínas ou
cadeia respiratória, sendo estas o foco desta revisão.
moléculas de RNA que normalmente se localizam
O conhecimento das características do genoma na mitocôndria.
mitocondrial e sua genética são importantes para a
compreensão da apresentação clínica e das variações
dessas doenças. O DNAmt é uma molécula circular Classificação genética das doenças mitocondriais
de 16569pb e codifica 13 subunidades protéicas da As doenças mitocondriais podem ser classificadas
cadeia respiratória, 22 tRNAs e dois genes para RNA geneticamente quando forem:
ribossômicos4. O DNAmt é responsável por somente
15% da síntese de proteínas da cadeia respiratória, o 1. de aparecimento esporádico (por rearranjos do
restante é feito pelo DNA nuclear (DNAn). O único DNAmt-duplicações ou deleções);
complexo respiratório que apresenta todas as subuni- 2. por herança materna (tipicamente por mutações
dades codificadas pelo DNAn é o complexo II, de ponto no DNAmt);
succinato desidrogenase. Ao contrário do DNAn, o 3. por herança mendeliana (tipicamente por defeitos
DNAmt é transmitido exclusivamente pela linhagem do DNA nuclear).
Rev. Neurociências 9(2): 60-69, 2001
62 Doenças Mitocondriais
Aparecimento esporádico (DNAmt) Herança materna
As mutações esporádicas causadoras de encefalo- É neste grupo que se incluem as síndromes clí-
miopatia mitocondrial descritas até o momento aco- nicas clássicas das doenças mitocondriais carac-
metem apenas o DNAmt e não são vistas no DNA terizadas por uma mutação de ponto localizada em
nuclear. Os exemplo típicos são a síndrome de diversos sítios do DNAmt. Até o momento já foram
Kearns-Sayre (SKS), a oftalmoplegia externa crônica descritas 128 mutações, e as mais freqüentes são a
progressiva (OECP) e a síndrome de Pearson. A3243G, a A8344G e a T8996G. É o grupo de doenças
Oftalmoplegia, ptose e miopatia com fibras ra- mitocondriais mais ostensivamente estudado.
jadas de vermelho (ragged-red fiber RRF) repre- Incluem-se nesse as seguintes síndromes clínicas:
sentam a tríade clínica que é altamente sugestiva de 1. epilepsia mioclônica e miopatia com RRF (myo-
mutações do DNA mitocondrial (DNAmt). Pacientes clocic epilepsy and ragged-red fiber, MERRF);
com essas manifestações podem ser classificados 2. encefalomiopatias mitocondriais, acidose láctica e
em três grupos, de acordo com a época do início episódios similares a acidentes vasculares cerebrais
dos sintomas e a gravidade de suas manifestações (mitochondrial encephalomyopathy, latic acidosis
clínicas. A variante mais grave é a síndrome de and stroke-like episodes, MELAS);
Kearns-Sayre (SKS), que é caracterizada por início
3. doença de Leigh e neuropatia, ataxia, retinite
antes dos 20 anos de idade, oftalmoplegia e retinite
pigmentosa – NARP;
pigmentosa, acrescentando-se um dos seguintes
comprometimentos: ataxia, hiperproteinorraquia ou 4. Neuropatia óptica hereditária de Leber (Leber’s
bloqueio completo cardíaco. Outros sintomas in- hereditary optic neuropathy, LHON).
cluem: diabetes mellitus (DM), surdez e sinais de
neurodegeneração. Alguns indivíduos apresentaram Epilepsia mioclônica e miopatia com RRF (myoclocic
na infância uma variante atípica designada como epilepsy and ragged-red fiber, MERRF9)
síndrome de Pearson caracterizada por anemia A síndrome MERRF pode se iniciar em qualquer
sideroblástica, leucopenia, trombocitopenia e insu- idade. As manifestações clínicas que são mais
ficiência pancreática exócrina, sendo a gravidade comumente associadas ao diagnóstico de MERRF são
desses sintomas muito variável, podendo inclusive a epilepsia (com crises mioclônicas generalizadas ou
levar à morte. Os pacientes com a síndrome de focais), a ataxia cerebelar e a miopatia. Seu curso é
Pearson, quando sobrevivem, desenvolvem, poste- progressivo e a biópsia muscular mostra RRF. Outras
riormente, a síndrome de Kearns-Sayre. manifestações incluem: demência, atrofia óptica,
Uma variante intermediária é a OECP, que se degeneração dos tratos corticoespinhais, neuropatia
manifesta principalmente com oftalmoplegia, ptose e periférica, surdez, disfunção tubular proximal, cardio-
discreta fraqueza muscular apendicular, geralmente miopatia, acidose láctica e hiperalaninemia. As
iniciando no adulto jovem, e é lentamente progressiva. mioclonias ocorrem em repouso e aumentam de fre-
A causa mais comum da SKS, da OECP e da síndrome qüência e amplitude com os movimentos, podendo
de Pearson é um rearranjo no DNAmt e consiste em ser associadas a descargas epileptiformes de grande
deleção ou duplicação do DNAmt (as duplicações e amplitude na região occipital, que pioram com a
as deleções podem ser encontradas concomitan- fotoestimulação. Potenciais evocados somatossensi-
temente no mesmo paciente). A deleção do DNAmt tivos corticais gigantes também podem ser vistos
consiste na perda de uma parte da molécula, freqüen- nessa patologia. Oitenta a 90% dos casos de MERRF
temente afetando o gene de um tRNA e um gene são decorrentes da mutação de ponto A8344G no
contíguo que codifica uma subunidade de proteínas DNAmt, o qual codifica o tRNALys. Uma pequena
da cadeia respiratória. Aproximadamente, 80% dos porcentagem dos casos de MERRF alberga a mutação
pacientes com SKS e 70% dos pacientes com OECP T8356C do DNAmt.
albergam rearranjos do DNAmt. Esses rearranjos
Encefalomiopatia mitocondrial, acidose láctica e
parecem estar associados a uma mutação espontânea
episódios similares a acidentes vasculares cerebrais
que ocorre depois da fertilização do oócito, não tendo
(mitochondrial encephalomyopathy, latic acidosis and
sido identificada nenhuma herança materna. Embora
stroke-like episodes, MELAS9)
os rearranjos do DNAmt sejam as causas mais fre-
qüentes dessas síndromes, mutações de ponto já As manifestações dessa doença podem aparecer
foram identificadas também como possíveis causa- em qualquer idade, mas ocorrem, principalmente,
doras dessa síndrome. antes dos 45 anos, sendo um diagnóstico diferencial
Rev. Neurociências 9(2): 60-69, 2001
Doenças Mitocondriais 63
de acidente vascular cerebral (AVC) em jovens. Esses considerada uma variante da síndrome de Leigh e é
pacientes apresentam-se com AVCs que geralmente uma doença multissistêmica do adulto jovem que
não respeitam território vascular, acometendo tanto apresenta, em várias combinações, neuropatia sensi-
pequenas como grandes artérias, e estão associados tiva, ataxia, crises convulsivas, demência e retinite
por vezes a convulsões e/ou enxaqueca. O diagnóstico pigmentosa. A biópsia muscular não apresenta RRF.
dessa doença, às vezes, pode ser difícil, uma vez que O defeito molecular principal é uma mutação de ponto
sintomas de envolvimento multissistêmico presentes (T8993G). Uma observação importante é que a mu-
nas doenças mitocondriais, como miopatia, ataxia, tação T8993G, quando encontrada em altas porcen-
cardiomiopatia, diabetes mellitus, retinite pigmentosa, tagens nos tecidos, apresenta-se fenotipicamente como
defeitos no túbulo renal proximal, acidose láctica e a doença de Leigh, enquanto na NARP a porcentagem
hiperalaninemia, podem estar ausentes. A ataxia dessa mutação encontrada nos tecidos é mais baixa.
cerebelar é freqüentemente observada em pacientes
com MELAS e pode preceder em muitos anos o Neuropatia óptica hereditária de Leber (Leber’s
aparecimento de episódios de AVC. Assim, um estudo hereditary optic neuropathy, LHON9)
genético é essencial para o diagnóstico. A LHON apresenta-se com um quadro de perda
Uma mutação no gene para o RNA transportador da acuidade visual central, indolor e de instalação
da leucina (tRNA LeuUUR), levando à troca de A por G aguda ou subaguda, ocorrendo usualmente dos 12
na posição do nucleotídeo 3243 do DNAmt (A3243G), aos 30 anos de idade. As alterações típicas dessa
é responsável por cerca de 80% dos casos de MELAS. síndrome, na fase aguda, incluem telangiectasias ao
A mutação na posição 8356 no RNA transportador da redor da papila óptica e edema das fibras nervosas
lisina (tRNA Lys ) foi associada tanto com MERRF ao redor do disco óptico ao exame oftalmológico.
quanto com MELAS. Uma característica importante Entretanto, desde o advento dos testes genéticos ficou
da mutação A3243G, bem como de alguns rearranjos claro que essas alterações retinianas não estão
do DNAmt, é que elas podem estar associadas à presentes em todos os casos. Embora mais de 12
presença de diabetes mellitus. Essa mutação também mutações do DNAmt estejam associadas a LHON,
foi vista como causa de SKS e de OECP. somente três são consideradas capazes de causar os
sintomas, mesmo na ausência de mutações adicionais
Doença de Leigh e neuropatia, ataxia, retinite sinérgicas, e respondem por aproximadamente 80%
pigmentosa – NARP9 dos casos de LHON. Embora a apresentação clínica
Podemos suspeitar de doença de Leigh ou ence- desses pacientes seja similar, a probabilidade de alguns
falopatia necrotizante subaguda quando houver uma pacientes virem a melhorar parcialmente se mostra
associação de anormalidades de nervos cranianos, diferente em cada uma dessas mutações. A mutação
disfunção respiratória e ataxia associada a imagens mais comum da LHON é a A11778G, que modifica
de ressonância magnética mostrando sinais hiperin- um gene de uma das subunidades protéicas do
tensos em T2 que acometem simetricamente gânglios Complexo I da cadeia respiratória (ND4). Essa
da base, cerebelo ou tronco cerebral. É uma doença mutação causa troca do aminoácido arginina por
de herança materna e pode estar associada também a histidina na posição 340 da cadeia polipeptídica
atraso do desenvolvimento neuropsicomotor, hipo- codificada por esse gene. Uma vez que a cegueira
tonia, crises convulsivas, ataxia, sinais piramidais, ocorra, a recuperação da visão é incomum, pois ocor-
cardiopatia hipertrófica, níveis elevados de lactato re em apenas em 5% a 8% dos casos. Uma caracte-
de alanina no sangue e/ou urina e retinite pigmentosa. rística importante nesses pacientes é que 50% a 80%
O início das manifestações geralmente ocorre na dos homens tornam-se cegos, enquanto apenas 8%
infância. Duas mutações do DNA mitocondrial são a 32% das mulheres cursam com tal perda. A segunda
as mais importantes causas dessa doença, a T8993G mutação mais comum é a G3460A, que promove uma
ou a T8993 no gene da ATPase 6. A mutação troca do aminoácido alanina por treonina na posição
T8993G é a mais freqüente e faz substituir o ami- 52 da cadeia polipeptídica codificada pelo gene ND1.
noácido leucina por arginina na cadeia polipeptídica Nesse caso, também os homens são mais afetados,
da ATPase 6, gerando uma disfunção na síntese de mas 22% dos pacientes podem recuperar a visão. A
ATP. Essa mutação só causa sintomas quando o terceira mutação mais freqüente é a T14484C, que
tecido afetado apresenta mais do que 60% a 70% de promove a mudança do aminoácido metionina na
DNAmt mutado. A atrofia cerebelar isolada ou a proteína codificada pelo gene ND6. Essa mutação é
retinopatia pigmentosa muitas vezes podem ser as considerada a mais benigna e cerca de 40% dos
únicas manifestações clínicas. NARP pode ser pacientes recuperam parcialmente a visão.
Rev. Neurociências 9(2): 60-69, 2001
64 Doenças Mitocondriais
Herança mendeliana (DNA nuclear) 2) mutação de ponto nos genes de proteínas hidrofó-
bicas NDUFS714 e NDUFS812, causando doença
As doenças mitocondriais de herança mendeliana
de Leigh;
consistem em um capítulo relativamente recente da
genética mitocondrial. Podem ser categorizadas 3) uma duplicação de 5 pares de base no gene de
como: uma proteína ligada ao complexo enxofre-ferro
NDUFS415, causando doença de Leigh.
a) defeitos em genes codificadores de proteínas
estruturais da mitocôndria (não discutidos nessa
Complexo II
revisão);
Mutações de genes nucleares do Complexo II
b) defeitos diretos em genes codificadores de enzimas
manifestam-se clinicamente de maneira muito diversa,
da cadeia respiratória;
incluindo os seguintes fenótipos:
c) defeitos em genes codificadores necessários para
1) SKS16;
a montagem ou a importação de proteínas mitocon-
driais; 2) fraqueza muscular17;
d) defeitos na sinalização intergenômica. 3) cardiomiopatia hipertrófica 18;
Até o momento, os defeitos do DNA nuclear clas- 4) doença de Leigh19;
sificados nos itens b e c afetam sempre direta ou 5) atrofia óptica com ataxia cerebelar 20;
indiretamente enzimas do complexo protéico do 6) paraganglioma hereditário21.
sistema de fosforilação oxidativa da mitocôndria. Até o momento, apenas três mutações patogênicas
Embora todos os componentes da cadeia respiratória
do Complexo II foram observadas. A primeira foi
tenham subunidades codificadas pelo DNA nuclear,
descrita no gene que codifica a subunidade FP ou
apenas mutações patogênicas dos Complexos I, II e
succinato desidrogenase A22, convertendo um aminoá-
IV foram identificadas. Nenhuma evidência em
cido arginina na posição 544 da cadeia protéica por
mutações nos Complexos III e V foi encontrada.
triptofano. Uma segunda e uma terceira mutações foram
encontradas em um mesmo gene modificando a cadeia
Complexo I
polipeptídica na posição 1, convertendo metionina por
É o maior complexo enzimático da cadeia respi- leucina e, na posição 52423, convertendo alanina por
ratória e compreende pelo menos 42 subunidades valina. Mutações no gene da succinato desidrogenase
diferentes, das quais apenas 7 são codificadas pelo D (cromossomo 11) também foram identificadas em
DNAmt. Talvez por isso uma deficiência isolada do
pacientes com paraganglioma hereditário, que é
Complexo I apareça como uma das causas mais
caracterizado pelo desenvolvimento de tumores
freqüentes de encefalopatia mitocondrial10.
vasculares benignos no pescoço e na cabeça, mais
Pacientes com deficiências no Complexo I usual- comumente na carótida. Essas foram as primeiras
mente apresentam a doença de Leigh como principal mutações em genes da cadeia respiratória que esta-
manifestação clínica com 40% a 50% dos casos, belecem uma relação causal direta com uma transfor-
tendo uma miocardiopatia associada11. Uma acidose mação neoplásica21.
láctica neonatal é também muito comum. Freqüen-
temente, os sintomas aparecem já ao nascimento ou Complexo IV
na primeira infância. Uma característica importante Apesar de deficiências isoladas no Complexo IV
nas deficiências desse complexo, derivadas de mu- já terem sido descritas, nenhuma mutação nos genes
tações no DNA nuclear, é que raramente existe um nucleares das subunidades que o formam foi encon-
envolvimento cardíaco. Apenas um caso foi descrito trada até o momento (apenas mutações patogênicas
com evidência de uma cardiopatia hipertrófica12, sem dos genes codificados pelo DNAmt)24. Entretanto,
RRFs na biópsia muscular. Apesar de a deficiência três mutações em genes nucleares que codificam pro-
do Complexo I ser relativamente freqüente, mutações teínas não relacionadas diretamente a uma das
patogênicas foram encontradas em apenas 4 das 35 subunidades deste Complexo, mas requeridas para a
subunidades codificadas pelo DNA nuclear. sua montagem e seu funcionamento, têm sido recen-
Outros genes envolvidos com deficiências fun- temente associadas a encefalomiopatias com defi-
cionais do Complexo I são: ciências da COX. Estas proteínas são a SURF125,
1) mutações de ponto no gene da flavoproteína a SCO226 e a COX-1027.
NDUFV113, que causa uma leucodistrofia fatal A SURF1 é uma proteína importada pela mito-
com epilepsia mioclônica; côndria, necessária para a montagem do Complexo
Rev. Neurociências 9(2): 60-69, 2001
Doenças Mitocondriais 65
IV propriamente dito, mas de função desconhecida. defeito foi descrita. Entretanto, a identificação desses
Mutações na SURF1 têm sido confirmadas por muitos pacientes é de extrema importância, uma vez que a
grupos e são associadas a doença de Leigh. administração da CoQ10 provê a melhora acentuada
A SCO2 é necessária para a inserção de cobre nas dos sintomas e do prognóstico no paciente.
subunidades 1 e 2 da COX. Mutações na SCO2 são
associadas com cardiomiopatia hipertrófica e ence- Defeitos na comunicação intergenômica
falomiopatia já notadas logo após o nascimento. Crianças Basicamente dois defeitos na sinalização interge-
afetadas apresentam dificuldades respiratórias, acidose nômica (comunicação entre o núcleo e a mitocôndria)
metabólica e morrem no primeiro ano de vida. Estudos foram descritos: a) deleções múltiplas (presença de
histoquímicos mostram que a deficiência de COX no deleções de diversos tamanhos em um mesmo tecido);
músculo de pacientes com a mutação SCO2 é mais b) depleção do DNAmt (diminuição na quantidade de
grave que com a mutação SURF1. Achados neuropato- DNAmt sem qualquer alteração na sua seqüência).
lógicos em familiares com mutação no gene para SCO2
incluem, ainda, heterotopia, gliose, atrofia e proliferação Deleções múltiplas do DNAmt
de vasos capilares. Até o momento, foram descritos A forma mais freqüente de deleções múltiplas é a
cinco tipos de mutações para o gene SCO2. oftalmoplegia externa progressiva de herança autos-
sômica dominante (OEP-AD). Manifesta-se princi-
A COX-10 codifica uma proteína que é a precur-
palmente com oftalmoplegia externa e ptose, de início
sora imediata do grupo prostético da subunidade
na idade adulta. Outras manifestações clínicas in-
COX-1. Pacientes homozigotos nessa mutação no
cluem: disfagia, disfonia, fraqueza na musculatura
exon 4 da COX-10 convertem asparagina em lisina
apendicular e facial, catarata, intolerância ao exer-
na posição 204 da proteína. Os sintomas apresen-
cício, cardiomiopatia, hipogonadismo, neuropatia
tados por esses pacientes incluem: hipotonia, ataxia, periférica, ataxia, tremor, rabdomiólise e acidose
miopatia e convulsões. O estudo bioquímico mostra láctica. Apresentam RRF e fibras COX-negativas à
uma redução na atividade da COX no músculo, nos biópsia muscular. Recentemente, descobriu-se que
linfócitos e nos fibroblastos. A análise por Western mutações no gene para ANT1 (adenina nucleotide
Blot evidencia uma total ausência de COX-2 com translocator) podem levar a quadro de OEP-AD34.
moderada redução dos níveis de COX-3, 4c. ANT é uma translocadora do nucleotídeo adenina.
As translocases são importantes para a passagem de
Complexo V metabólitos através da membrana mitocondrial in-
Até o momento, nenhuma mutação patogênica foi terna. Três cromossomos têm sido identificados na
encontrada no DNA nuclear afetando o Complexo V, OEP-AD: 10q24, 3q14.1-21.2 e 4q34-35.
muito embora mutações codificadas pelos genes do Deleções múltiplas também podem ser encontradas
DNAmt foram associadas em artigo de DiMauro e sob herança autossômica recessiva, mas em síndromes
Andreu 28 com doenças humanas. Uma possível com comprometimento mais multissistêmico como a
candidata em apresentar uma mutação no Complexo oftalmoplegia-cardiomiopatia autossômica recessiva
V dos genes do DNA nuclear é a doença de Luft, já (ARCO), ataxia sensitiva, neuropatia, disartria e
descrita anteriormente. oftalmoplegia (SANDO) e encefalomiopatia neuro-
gastrointestinal mitocondrial (MNGIE). Apesar da
Coenzima Q10 (CoQ10) heterogeneidade dessas doenças, os músculos extra-
Apesar de não fazer parte de nenhum dos com- oculares são consistentemente afetados. Em 1997,
plexos da cadeia respiratória, é uma molécula móvel mutações no gene para timidina fosforilase foram
que participa no transporte de elétrons como seu identificadas como alterações responsáveis por
receptor, provindos dos Complexos I e II e os transfe- MNGIE 35. Até o momento, foram identificadas 16
rindo para o Complexo III. Defeitos parciais (20% a mutações. Normalmente, a timidina fosforilase contribui
30%) da CoQ10 estão associados com a SKS e várias para manter o nível sérico da timidina. Mutações nesse
miopatias29,30,31,32,33. A fraqueza muscular geralmente gene levam à perda dessa função em leucócitos perifé-
é pequena e episódios de mioglobinúria podem ser ricos e acredita-se que o desbalanço no pool de
induzidos com exercício, febre ou convulsões. Obser- deoxinucleotídeos acarretaria a depleção e as deleções
va-se uma diminuição da atividade dos Complexos I múltiplas. O diagnóstico de MNGIE é feito pelo achado
e II ou I e III (todos os quais requerem a CoQ10) na de seis características: a) oftalmoplegia externa progres-
análise bioquímica. A biópsia muscular mostra RRFs siva; b) dismotilidade gastrointestinal severa; c)
e inclusões lipídicas. Nenhuma mutação para tal caquexia; d) neuropatia periférica, e) leucoencefalopatia
Rev. Neurociências 9(2): 60-69, 2001
66 Doenças Mitocondriais
difusa; f) evidência de disfunção mitocondrial fatal36. A depleção do DNAmt pode ser causada por
(histológica, bioquímica ou genética). Inicia-se por volta problemas na replicação do DNAmt, provocando
dos 18 anos de idade e as manifestações gastrointestinais diminuição na quantidade do DNAmt na célula e, conse-
são as características predominantes e frequëntemente qüentemente, levando à disfunção mitocondrial por
debilitantes. A biópsia muscular revela alterações déficit na síntese de proteínas mitocondriais. Até o
neurogênicas, RRF e fibras COX-negativas. Outra momento, não foi descoberto o gene envolvido para a
doença autossômica recessiva ligada ao cromossomo forma herdada de depleção. A síndrome de MNGIE
4p16, que em uma pequena porcentagem dos casos pode aparecer também com o fenótipo de uma depleção
exibe múltiplas deleções do DNAmt, é a síndrome de do DNAmt, além das deleções múltiplas. O tratamento
Wolfram, caracterizada por diabetes insipidus, diabetes com AZT ou análogos pode produzir uma miopatia
mellitus, atrofia óptica e surdez. com proliferação mitocondrial, mas é reversível com
a retirada da droga. O AZT bloqueia a replicação do
Depleção do DNAmt DNAmt pela ação na DNA polimerase gama.
O quadro de depleção do DNAmt pode ser herdado
ou aparecer secundariamente, como pelo uso de AZT,
Outros aspectos
ddC ou ddl. A forma herdada é transmitida sob herança
autossômica recessiva e manifesta-se por fraqueza, A apresentação clínica das doenças mitocondriais
hipotonia e atraso no desenvolvimento. A apresentação é muito diversa e pode se manifestar simplesmente
clínica é heterogênea, muitas crianças apresentam como uma intolerância ao exercício e até como
somente miopatia, outras, somente hepatopatia e doenças multissistêmicas acometendo o sistema
algumas, envolvimento multissistêmico (coração, nervoso central e periférico e os sistemas endócrino,
cérebro e rim). A evolução é grave e quase sempre hematopoiético, gastrointestinal, óptico, etc. (Tabela
Tabela 1 Principais manifestações clínicas das doenças mitocondriais
Tecidos Sinais/sintomas
Sistema nervoso central Convulsões
Ataxia
Mioclonia
Retardo psicomotor
Regressão psicomotora
Hemiparesia/hemianopsia
Síndrome enxaquecosa
Distonia
Perda auditiva neurossensorial
Nervos periféricos Neuropatia periférica
Muscular Fraqueza/intolerância ao exercício
Oftalmoplegia
Ptose
Oftalmológico Retinopatia pigmentar
Atrofia óptica
Catarata
Hematopoiético Anemia sideroblástica
Endócrino Diabetes mellitus
Baixa estatura
Hipoparatiroidismo
Cardíaco Bloqueio de condução
Cardiomiopatia
Gastrointestinal Disfunção pancreática exócrina
Pseudo-obstrução intestinal
Renal Síndrome de Fanconi
Laboratorial Acidose láctica
Biópsia muscular com ragged red fibres (RRF)
Rev. Neurociências 9(2): 60-69, 2001
Doenças Mitocondriais 67
1) 29. De uma maneira genérica, o diagnóstico deve seu entendimento genotípico tem sido de funda-
ser suspeitado em qualquer paciente com uma doença mental importância para podermos avaliar o
multissistêmica que particularmente envolva tecidos prognóstico (como no caso da LHON). O seqüen-
com alta demanda de energia, como o cérebro, o ciamento do DNA humano, bem como o desenvol-
coração e os músculos. Uma característica das vimento de modelos experimentais para as doenças
doenças mitocondriais (embora não obrigatória) é mitocondriais, permite prever que um grande avanço
evidenciar sinais de proliferação mitocondrial no entendimento da fisiopatologia dessas doenças
anormal (RRF), observamos a biópsia muscular. ocorrerá nos próximos anos.
Essas fibras geralmente apresentam deficiência da Além disso, a pesquisa das doenças mitocondriais
citocromo-c oxidase (COX) – Complexo IV, de- parece extrapolar o estigma de ser uma pesquisa
monstrada pela histoquímica. A análise imunois- voltada ao entendimento de doenças raras, uma vez
toquímica dos tecidos afetados e a avaliação gené- que a mitocôndria tem sido ligada ao processo de
tico-molecular auxiliam e confirmam o diagnóstico, apoptose, neurodegeneração e envelhecimento. Isso
mas a pesquisa das mutações específicas deve ser tem atraído a atenção de pesquisadores de diferentes
direcionada pela apresentação clínica de cada pa- áreas na esperança de que a mitocôndria possa ser
ciente, devido ao grande número de mutações encon- alvo de drogas que tenham a capacidade de alterar a
tradas nessas doenças. sobrevivência das células, bem como de modificar o
É interessante notar que deficiências na cadeia curso de doenças neurodegenerativas.
respiratória também foram vistas na doença de
Parkinson37, na doença de Huntington38 e na doença
de Alzheimer39. A correlação entre esses achados e a SUMMARY
importância de possíveis alterações primárias que Mitocondrial disorders
possam ocorrer nos genes e nas proteínas da cadeia
Mitocondrial disorders are a relatively recent
respiratória, para a fisiopatologia dessas doenças,
chapter in the study of human diseases and unders-
ainda necessitam de novos esclarecimentos.
tanding the physiopathological implications requires a
Outro ponto importante que tem sido pesquisado genetic approach of each patient. The correct function
é a relação entre a apoptose e a mitocôndria. A apop- of mitocondria depends on the interaction of 2
tose é de fundamental importância na embriogênese genomes, nuclear and mitocondrial. In this review we
em processos neurodegenerativos em diversas fun- offer an introduction on mitocondrial genetics, current
ções fisiológicas. Inúmeras proteínas regulatórias da classification of mitocondrial diseases and brief
apoptose exercem sua ação pela indução de mega- description of clinical aspects.
poros na membrana externa e interna da mitocôndria.
O uso de drogas, como a ciclosporina, tem a capa-
cidade de fechar esses megaporos e prevenir a Keywords
apoptose 40. Essas recentes descobertas têm colocado
a mitocôndria como uma via crítica para o desenca- Mitochondria, cytochrome-c oxidase, mitochon-
deamento da morte celular programada. O enve- drial DNA, mitochondrial disease.
lhecimento também é outro foco de pesquisa, porque
tem se relacionado à mitocôndria, pois alterações Referências
bioquímicas e rearranjos do DNAmt também são
encontrados em tecidos de idosos 41. 1. Ernster L, Ikkos D, Luft R. Enzymic activites of human
skeletal muscle mitochondria: A tool in clinical metabolic
research. Nature, 184:5, 1959.
Conclusões 2. Shapira Y, Harel S, Russell A. Mitochondrial encepha-
lomyopathies: a group of neuromuscular disorders with
O entendimento do funcionamento da mito- defects in oxidative metabolism. Isr J Med Sci, 13:161-
4,1977.
côndria e suas peculiaridades genéticas aumentou
3. Nass MMK, Nass S. Intramitochondrial fibers with DNA
consideravelmente, auxiliando a compreensão de characteristics: I. Fixation and electron staining reactions.
inúmeras doenças aparentemente tão distintas, J Cell Biol, 19:593, 1963.
unificando-as sob um prisma genético e fisiopa- 4. Anderson S, Bankier AT, Barrel BG, de Bruijin MH,
tológico comum. Apesar de, até o momento, não Couson AR, Drovin J, Eperen IC, Nierlich EP, Roe BA,
Sanger F, Shreier PH, Smith AJ, Staden R, Young IG.
existir tratamento específico efetivo para as doenças Sequence and organization of the human, mitochondrial,
mitocondriais (com exceção da deficiência CoQ10), genome. Nature, 290:457-65, 1981.
Rev. Neurociências 9(2): 60-69, 2001
68 Doenças Mitocondriais
5. Holt IJ, Cooper JM, Morgan-Hughes JA, Harding AE. mitochondrial respiratory chain in late-onset optic atrophy
Deletions of muscle mitochondrial DNA. Lancet, 1:1462, and ataxia. Ann Neurol, 39:224-32, 1996.
1988. 21. Baysal BE, Ferrell RE, Willett-Brozick JE, Lawrence EC,
6. Wallace DC, Lott MT, Hodge JA, Schurr TG, Lezza AMS, Myssiorek D, Bosch A, van der Mey A, Taschner PE,
Elsas II LJ, Nikoskelainen EK. Mitochondrial DNA mutation Rubinstein WS, Myers EN, Richard CW, Cornelisse CJ,
associated with Leber’s hereditary optic neuropathy. Devilee P, Devlin B. Mutations in SDHD, a mitochondrial
Science, 242:1427-30, 1988. complex II gene, in hereditary paraganglioma. Science,
7. Mitochondrial encephalomyopathies: gene mutation. 287:848-51, 2000.
Neuromusc Disord, 11:332-7, 2001. 22. Burgeois M, Goutieres F, Chretien D, Rustin P, Munnich
8. Morgan-Hughes J A Mitochondrial disease. In: Engel AG, A, Aicardi J. Deficiency in complex II of the respiratory
Franzini-Armstrong C. Myology – Basic and Clinical 2. chain presenting as leukodystrophy in two sisters with
ed. USA, Mc Graw Hill International 1994, (2) 1610-60. Leigh syndrome. Brain Dev, 14:404-8, 1992.
9. Shoffner JM. Oxidative phosphorylation disease diag- 23. Adams PL, Lightowlwers RN, Turnbull DM. Molecular
nosis. Ann NY Acad Sci, 893:42-60, 1999. analysis of cytochrome-c oxidase deficiency in Leigh’s
10. Robinson BH. Human complex I deficiency: clinical syndrome. Ann Neurol, 41:268-70, 1997.
spectrum and involvement of oxygen free radicals in the 24. Valnot I, Kassis J, Chretien D, DE Lonlay P, Parfait B,
pathogenicity of the defect. Biochim Biophys Acta, Munnich A, Kachaner J, Rustin P, Rotig A. A mitochondrial
1364:271-86, 1998. cytochrome-b mutation but no mutations of nuclear
11. Rahman S, Blok R, Dahl H-HM, Danks DM, Kirkby DM, encoded subunits in ubiquinol cytochrome-c reductase
Chow CW, Chr istodoulou J, Thorbur n DR. Leigh (complex III) deficiency. Hum Genet, 104:460-6, 1999.
syndrome: clinical features and biochemical and DNA 25. Tiranti V, Hoertnagel K, Carrozzo R, Galimberti C, Munaro
abnormalities. Ann Neurol, 39:343-51, 1996. M, Granatiero M, Zelante L, Gasparini P, Marzella R,
12. Loeffen J, Smeitink J, Triepels R, Smeets R, Schuelke Rocchi M, Bayona-Bafaluy MP, Enriquez JA, Uziel G,
M, Sengers R, Trijbels F, Hamel B, Mullaart R, van den Bertini E, Dionisi-Vici C, Franco B, Meitinger T, Zeviani
Heuvel L. The first nuclear-encoded complex I mutation M. Mutations of SURF-1 in Leigh disease associated with
in a patient with Leigh syndrome. Am J Hum genet, cytochrome-c oxidase deficiency. Am J Hum Genet,
63:1598-608, 1998. 63:1609-21, 1998.
13. Schuelke M, Smeitink J, Mariman E, Loeffen J, Plecko B, 26. Papadopoulou LC, Sue SM, Davidson MM, Tanji K, Nishino
Trijbels F, Stockler-Ipsiroglu S, van den Heuvel L. Mutant I, Sadlock Je, Krishna S, Walker W, Selby J, Glerum Dm,
NDUFV1 subunit of mitochondrial complex I causes Van Coster R, Lyon G, Scalais E, Lebel R, Kaplan P,
leukodystrophy and myoclonic epilepsy. Nat Genet, Shanske S, De Vivo DC, Bonilla E, Hirano M, Dimauro S,
21:260-1, 1999. Schon EA. Fatal infantile cardioencephalomyopathy with
14. Trielps RH, van den Heuvel LP, Loeffen JLCM, Buskens COX deficiency and mutations in SCO2, a COX assembly
CAF, Smeets RJP, Gozalbo MFR, Budde SMS, Mariman gene. Nat Genet, 23:333-7, 1999.
EC, Wijburg FA, Barth PG, Trijbels JMF, Smeitink JAM. 27. Valnot I, von Kleist-Retzon JC, Barrientos A, Corbatyuk
Leigh syndrome associated with a mutation in the M, Taanman JW, Mehaye B, Dustin P, Tzagoloff A, Munnich
NDUFS7 (PSST) nuclear encoded subunit of complex I. A, Rotig A. A mutation in the human heme A: Farnesyl-
Ann Neurol, 45:787-90, 1999. tranferase gene (COX-10) causes cytocrome-c oxidase
15. Van den Heuvel L, Ruitenbeek W, Smeets R, Gelman- deficiency. Hum Mol Genet 9:1245-9, 2000.
Rohan Z, Elpeleg O, Loeffen J, Trijbels F, Mariman E, de 28. DiMauro S & Andreu AL. Mutations in mtDNA: are we
Bruijn D, Smeitink J. Demonstration of a new pathogenic scraping the bottom of the barrel? Brain Pathol, 10:431-
mutation in human complex I deficiency: a 5-bp duplication 41, 2000.
in the nuclear gene encoding the 18-kD (AQDQ)subunit.
Am J Hum Genet, 62:262-8, 1998. 29. Fischer JC, Ruitenbeek W, Gabreels FJ, Janseen AJ,
Renier WO, Sengers RCA, Stadhouders AM, ter Laak HJ,
16. Rivner MH, Shamsnia M, Swift TR, Trefz J, Roesel RA, Trijbels JM, Veerkamp JH. A mitochondrial encepha-
Car ter AL, Yanamura W, Hommes FA. Kearns-Sayre lomyopathy: the first case with an established defect at
syndrome and complex II deficiency. Neurology, 39:693-
the level of coenzyme Q. Eur J Pediatr, 144:441-4, 1986.
6, 1989.
30. Matsuoka T, Maeda H, Goto Y-I, Nonaka I. Muscle
17. Haller RG, Henriksson KG, Jorfeld L, Hultman E, Wilbom
coenzyme Q10 in mitochondrial encephalomyopathies.
R, Sahlin K, Areskog NH, Gunder M, Ayyad K, Blomqvist
Neuromusc Disord, 1:443-7, 1991.
CG, Hall RE, Thuillier P, Kennaway NG, Lewis S. Deficiency
of skeletal muscle succinate dehydrogenase and aconi- 31. Ogasahara S, Yorifuji S, Nishikawa Y, Takahashi MKW,
tase. Pathophysiology of exercise in a novel human muscle Hazama T, Ankamura Y, Hashimoto S, Kono N, Taui S.
oxidative defect. J Clin Invest, 88:1197-206, 1991. Improvement of abnormal pyruvate metabolism and
18. Rustin P, Lebidois J, Chretien D, Bourgeron T, Piechaud cardiac conduction defect with coenzyme Q10 in Kearns-
JF, Rotig A, Sidi D, Munnich A. The investigation of Sayre syndrome. Neurology, 35:372-7, 1985.
respiratory chain disorders using endocardial biopsies. 32. Ziers S, Jahns G, Jerusalem F. Coenzyme Q in serum and
J Inherit Metab Dis, 16:541-4, 1993. muscle of 5 patients with Kearns-Sayre syndrome and 12
19. Bourgeron T, Rustin P, Chretien D, Birch-Machin M, patients with opthalmoplegia plus. J Neurol, 236:97-101,
Bourgeois M, Viegas-Pequignot E, Munnich A, Rotig A. 1989.
Mutation of a nuclear succinate dehydrogenase gene 33. Boitier E, Degoul F, Desguerre I, Charpentier C, Francois
results in mitochondrial respiratory chain deficiency. Nat D, Ponsot G, Diry M, Rustin P, Marsac C. A case of
Genet, 11:144-9, 1995. mitochondrial encephalopathy associated with a muscle
20. Taylor RW, Birch-Machin MA, Schaefer J, Taylor L, Shakir coenzyme Q10 deficiency. J Neurol Sci, 156:41-6, 1998.
R, Ackerell BAC, Cochran B, Bindoff LA, Jackson MJ, 34. Kaukonen J, Juselius J, Tirani V, Kyttala A, Zeviani M,
Griffiths P, Turnbull DM. Deficiency of complex II of the Comi G, Keranen S, Comi GP, Keranen S, Peltonen L,
Rev. Neurociências 9(2): 60-69, 2001
Doenças Mitocondriais 69
Suoraloinen A. Role of adenine nucleotide tranlocator 1 40. Susin SA, Zamzami N, Kroemer G. Mitochondria as
in mtDNA maintenance. Science, 289:782-5, 2000. regulators of apoptosis: doubt no more. Biochim Biophis
35. Nishino I, Spinazola A, and Hirano M Thymidine phos- Acta, 1366:151-65, 1998.
phorylase gene mutations in MNGIE, a human mitochon- 41. Tanaka M, Kovalenko SA, Gong J-S, Borgeld, H-JW,
drial disorder. Science, 283:589-692, 1999. Katsumata K, Hayakawa M, Yoneda M, Ozawa T.
Accumulation of deletions and point mutations in
36. Moraes C, Shanske S, Tritschler H, Aprille J, Andretta F, mitochondrial genome in degenerative diseases. Ann NY
Bonilla E, Schon EA. mtDNA depletion with variable tissue Acad Sci, 786: 102-11, 1996.
expression: a novel genetic abnormality in mitochondrial
diseases. Am J Hum Genet, 48:492-501, 1991.
37. Schapira AHV. Oxidative stress and mitochondrial
dysfunction in neurodegeneration. Curr Opin Neurol,
9:260-4, 1996.
38. Gu M, Cooper JM, Gash M, Mann VM, Javoy-Agid F, Endereço para correspondência:
Schapira AHV. Mitochondrial defect in Huntington’s Dra. Célia Harumi Tengan
disease caudate nucleus. Ann Neurol, 39:385-9, 1996. Edifício Acadêmico Horácio Kneese de Mello
39. Bonilla E, Tanji K, Hirano M, Vu TH, DiMauro S, Schon EA. Unifesp – EPM
Mitochondrial involvement in Alzheimer’s disease. Biochim R. Pedro de Toledo, 781 – 7o andar
Biophys Acta, 1410:171-82, 1999. CEP 04039-032 – São Paulo, SP
Rev. Neurociências 9(2): 60-69, 2001
You might also like
- Encefalomiopatias mitocondriais: revisão das principais síndromesDocument5 pagesEncefalomiopatias mitocondriais: revisão das principais síndromesthyene20No ratings yet
- Pesquisa Sobre BioengenhariaDocument2 pagesPesquisa Sobre BioengenhariaGuilherme DiaconiucNo ratings yet
- Desordens Mitocondriais: Uma Revisão Sobre as Principais Síndromes e ClassificaçãoDocument5 pagesDesordens Mitocondriais: Uma Revisão Sobre as Principais Síndromes e ClassificaçãoLara RochaNo ratings yet
- Mitocôndria e Síndrome de LeighDocument16 pagesMitocôndria e Síndrome de LeighVictor dos ReisNo ratings yet
- Hereditariedade mitocondrial e suas implicações médicasDocument7 pagesHereditariedade mitocondrial e suas implicações médicasEliana RodriguesNo ratings yet
- Aula 8 DNA MitocondrialDocument37 pagesAula 8 DNA Mitocondrialapi-19738142No ratings yet
- Vivo CitologiaDocument4 pagesVivo CitologiaLua SolNo ratings yet
- Resumo MitocôndriasDocument3 pagesResumo Mitocôndriasr7g2cbx6j8No ratings yet
- Módulo de Proliferação CelularDocument43 pagesMódulo de Proliferação CelularIsabella GonçalvesNo ratings yet
- Progeria e A Divisão Celular Genética Do EnvelhecimentoDocument3 pagesProgeria e A Divisão Celular Genética Do EnvelhecimentoSergio Miguel da SilvaNo ratings yet
- Palestra Congresso InternacionalDocument118 pagesPalestra Congresso Internacionalcarol18fontouraNo ratings yet
- Artigo Sobre Doeças MitocondriaisDocument3 pagesArtigo Sobre Doeças MitocondriaisAndrea Lima de OliveiraNo ratings yet
- Biologia 11o DNA, RNA, Proteínas e Ciclo CelularDocument12 pagesBiologia 11o DNA, RNA, Proteínas e Ciclo CelularJoão RodriguesNo ratings yet
- Citoesqueleto 2 2019Document79 pagesCitoesqueleto 2 2019Roberto JunioNo ratings yet
- DNA, genes e síntese de proteínas emDocument8 pagesDNA, genes e síntese de proteínas emtom3s3cardoso-2No ratings yet
- Morte CelularDocument3 pagesMorte CelularLeticia KirchimairNo ratings yet
- Estudo Dirigido Prova BiocelDocument5 pagesEstudo Dirigido Prova BiocelJoão Vitor AlvesNo ratings yet
- Mitocôndrias: a organela celular responsável pela respiração e produção de energiaDocument31 pagesMitocôndrias: a organela celular responsável pela respiração e produção de energiamamfm5No ratings yet
- Santa Rita Desta É de VezDocument138 pagesSanta Rita Desta É de VezEva Natália Mendes JardimNo ratings yet
- Resumo Biologia (11 )Document27 pagesResumo Biologia (11 )Paulo MendesNo ratings yet
- 1 - Crescimento e Renovação CelularDocument5 pages1 - Crescimento e Renovação CelularFranciscoPaixão100% (3)
- Herança Extranuclear: Mitocôndrias e CloroplastosDocument8 pagesHerança Extranuclear: Mitocôndrias e CloroplastosSergio Alves Pessoa Pessoa100% (1)
- Introdução ao genoma humanoDocument5 pagesIntrodução ao genoma humanobichoguaraNo ratings yet
- Alteração genéticaDocument6 pagesAlteração genéticaCarolina JorgeNo ratings yet
- Sebenta Biologia 11.º Ano - Unidade 5 - Crescimento e Renovação CelularDocument8 pagesSebenta Biologia 11.º Ano - Unidade 5 - Crescimento e Renovação CelularDaniel Lopez GomesNo ratings yet
- Paradoxo Do Valor CDocument8 pagesParadoxo Do Valor CweleidaabreuNo ratings yet
- Estudo Dirigido Prova BiocelDocument4 pagesEstudo Dirigido Prova BiocelJoão Vitor AlvesNo ratings yet
- Biologia ResumosDocument10 pagesBiologia Resumosmariana barbeiroNo ratings yet
- Resumoglobalbiologia 11 AnoDocument22 pagesResumoglobalbiologia 11 AnoAna CamposNo ratings yet
- DNA RNA proteínas ciclo celular replicaçãoDocument13 pagesDNA RNA proteínas ciclo celular replicaçãoVinícius Alves Moura67% (3)
- Divisão celular: mitose e meioseDocument8 pagesDivisão celular: mitose e meioseDaxter Ribeiro SantosNo ratings yet
- Biologia celular: núcleo, ciclo celular e mitoseDocument12 pagesBiologia celular: núcleo, ciclo celular e mitoseElaine Cosma FiorelliNo ratings yet
- Perguntas Freq Bio MolecularDocument14 pagesPerguntas Freq Bio Molecularcabij11227No ratings yet
- Estudo Dirigido - GabaritoDocument4 pagesEstudo Dirigido - GabaritoMaria Eduarda GrisoliaNo ratings yet
- A Base Celular Da VidaDocument14 pagesA Base Celular Da VidaCarolina RodriguesNo ratings yet
- Resumo 1º Módulo de CHGDocument9 pagesResumo 1º Módulo de CHGTaináF.FonsecaNo ratings yet
- s13 Ciclo CelularDocument5 pagess13 Ciclo CelularJuan Diego Huaman RamirezNo ratings yet
- Material genético: Identificação, estrutura e funçãoDocument42 pagesMaterial genético: Identificação, estrutura e funçãoAlana NascimentoNo ratings yet
- Origem endossimbiótica de organelasDocument6 pagesOrigem endossimbiótica de organelasSahhwe AsdaksjdlNo ratings yet
- Biologia Molecular: Genoma, Cromossomos, Genes e Replicação do DNADocument8 pagesBiologia Molecular: Genoma, Cromossomos, Genes e Replicação do DNAALLYCE PEREIRA COELHONo ratings yet
- Ribossomos RER REL tradução proteínasDocument8 pagesRibossomos RER REL tradução proteínasAndre Luiz do NascimentoNo ratings yet
- Dosimetria e Proteção RadiológicaDocument9 pagesDosimetria e Proteção RadiológicafrodriguesNo ratings yet
- 2 Lista Monitoria - Parte 1Document4 pages2 Lista Monitoria - Parte 1Matheus FerreiraNo ratings yet
- REVISÃO TECIDOS MUSCULARES E NERVOSODocument14 pagesREVISÃO TECIDOS MUSCULARES E NERVOSOAndrezza CristinaNo ratings yet
- Aula 3 Organelas CitoplasmaticasDocument24 pagesAula 3 Organelas CitoplasmaticasColoristajrNo ratings yet
- Livro M3 Patologia PDFDocument127 pagesLivro M3 Patologia PDFguilhermegexNo ratings yet
- Patologia CelularDocument6 pagesPatologia CelularMargarida FonsecaNo ratings yet
- Funções mitocondriais: apoptose, termorregulação e DNADocument12 pagesFunções mitocondriais: apoptose, termorregulação e DNAmarlos AntônioNo ratings yet
- Mitocôndria e Cloroplasto: Priscila M. M. de LeonDocument63 pagesMitocôndria e Cloroplasto: Priscila M. M. de Leonfphenriques77No ratings yet
- O núcleo celular: estrutura, função e componentesDocument4 pagesO núcleo celular: estrutura, função e componentesEduardo GonçalvesNo ratings yet
- Celulas Do Sistema ImuneDocument4 pagesCelulas Do Sistema Imunetchelyhilario90No ratings yet
- Divisão Celular e CrescimentoDocument40 pagesDivisão Celular e CrescimentotrilibiteNo ratings yet
- Membranas e transporte em células procariotasDocument3 pagesMembranas e transporte em células procariotasBixete Mariana DraminNo ratings yet
- DNA, RNA e ciclo celularDocument13 pagesDNA, RNA e ciclo celularTiago MendesNo ratings yet
- Comunicação Celular por Sinais QuímicosDocument2 pagesComunicação Celular por Sinais QuímicosMaria Theresa MoreiraNo ratings yet
- Biologia e Geologia ResumosDocument21 pagesBiologia e Geologia ResumosLaura RichterNo ratings yet
- Crescimento e Renovação Celular 1Document5 pagesCrescimento e Renovação Celular 1migasmaria2007No ratings yet
- Células-tronco Mesenquimais Para O Tratamento Da Doença Do Enxerto Contra O Hospedeiro Aguda Resistente Aos CorticosteroidesFrom EverandCélulas-tronco Mesenquimais Para O Tratamento Da Doença Do Enxerto Contra O Hospedeiro Aguda Resistente Aos CorticosteroidesNo ratings yet
- Exercícios Geografia 5a sérieDocument12 pagesExercícios Geografia 5a sérieSilvestre Gonçalves de Souza100% (1)
- Bioquimica Clinica PraticasDocument3 pagesBioquimica Clinica PraticasSilvestre Gonçalves de SouzaNo ratings yet
- Autran JR - Bioquimica AplicadaDocument47 pagesAutran JR - Bioquimica AplicadaSilvestre Gonçalves de SouzaNo ratings yet
- Suple - 76 - 21 - 8cap 8Document6 pagesSuple - 76 - 21 - 8cap 8Silvestre Gonçalves de SouzaNo ratings yet
- Suple - 73 - 21 - 5cap 5Document7 pagesSuple - 73 - 21 - 5cap 5Silvestre Gonçalves de SouzaNo ratings yet
- Apostila Bioquimica 2Document112 pagesApostila Bioquimica 2_nei100% (6)
- Apostila Completa 2009 BioquimicaDocument148 pagesApostila Completa 2009 BioquimicaSilvestre Gonçalves de SouzaNo ratings yet
- 07 - A Economia No LarDocument23 pages07 - A Economia No LarErasmo Nascimento94% (16)
- A História Do Cristianismo e de Suas EscriturasDocument28 pagesA História Do Cristianismo e de Suas EscriturasAdv AlmeidaNo ratings yet
- 22técnicas de Bioquimica e Biologia MolecularDocument5 pages22técnicas de Bioquimica e Biologia MolecularSilvestre Gonçalves de SouzaNo ratings yet
- QuilotóraxDocument7 pagesQuilotóraxMárcia NPNo ratings yet
- Suple - 75 - 21 - 7cap 7Document7 pagesSuple - 75 - 21 - 7cap 7Silvestre Gonçalves de SouzaNo ratings yet
- Pontos 2010 BioquimicaDocument1 pagePontos 2010 BioquimicaSilvestre Gonçalves de SouzaNo ratings yet
- Suple - 70 - 21 - 2cap 2Document4 pagesSuple - 70 - 21 - 2cap 2Silvestre Gonçalves de SouzaNo ratings yet
- Suple - 72 - 21 - 3cap 3Document8 pagesSuple - 72 - 21 - 3cap 3Silvestre Gonçalves de SouzaNo ratings yet
- Molebio 1Document15 pagesMolebio 1Silvestre Gonçalves de SouzaNo ratings yet
- Suple - 71 - 21 - 4cap 4Document8 pagesSuple - 71 - 21 - 4cap 4Silvestre Gonçalves de SouzaNo ratings yet
- Coleta e Preservação Do Líquido Pleural e Biópsia PleuralDocument7 pagesColeta e Preservação Do Líquido Pleural e Biópsia PleuralRaphael RamosNo ratings yet
- O Homem Do Avesso Anatomia e Fisiologia HumanaDocument4 pagesO Homem Do Avesso Anatomia e Fisiologia HumanaSilvestre Gonçalves de SouzaNo ratings yet
- Principios Gerais de FisiologiaDocument30 pagesPrincipios Gerais de FisiologiaVinicius FerreiraNo ratings yet
- Diretrizes Bras. em PAC em Pediatria SBPT - 2009Document19 pagesDiretrizes Bras. em PAC em Pediatria SBPT - 2009César MouraNo ratings yet
- RFM 0007 00002700 Art03Document8 pagesRFM 0007 00002700 Art03Silvestre Gonçalves de SouzaNo ratings yet
- PGCPD065Document2 pagesPGCPD065Silvestre Gonçalves de SouzaNo ratings yet
- Nat Lia Posser TrentinDocument13 pagesNat Lia Posser TrentinSilvestre Gonçalves de SouzaNo ratings yet
- IGREJA Construtora Renovadora Formadora Da CivilizaçãoDocument15 pagesIGREJA Construtora Renovadora Formadora Da CivilizaçãoRaul MarcelNo ratings yet
- Mensagensdereflexoes PDFDocument17 pagesMensagensdereflexoes PDFPriscila Gomes SouzaNo ratings yet
- A Particularidade de Ser Um FungoDocument11 pagesA Particularidade de Ser Um Fungoapi-3854652100% (3)
- Mensagem SubliminarDocument3 pagesMensagem SubliminarSilvestre Gonçalves de SouzaNo ratings yet
- Manual ExamesDocument82 pagesManual ExamesSilvestre Gonçalves de Souza67% (3)
- Tecido EpitelialDocument39 pagesTecido EpitelialDiego100% (2)
- Fatores da não adesão ao tratamento da tuberculoseDocument125 pagesFatores da não adesão ao tratamento da tuberculoseFernando Fernandes50% (2)
- Microagulhamento Como Recurso de Tratamento NoDocument10 pagesMicroagulhamento Como Recurso de Tratamento NoIasmine PedrosoNo ratings yet
- Celulite: causas, sintomas e tratamentosDocument29 pagesCelulite: causas, sintomas e tratamentosJemima Daniela Dias MoraesNo ratings yet
- Humanidade e Animalidade segundo Tim IngoldDocument2 pagesHumanidade e Animalidade segundo Tim IngoldMariana SimõesNo ratings yet
- Exercícios - CiênciasDocument2 pagesExercícios - CiênciasMonica AlvesNo ratings yet
- Metabolismo No JejumDocument2 pagesMetabolismo No JejumNayene Martinez100% (2)
- Resumo - Mitose e MeioseDocument2 pagesResumo - Mitose e MeioseIsadora TouricesNo ratings yet
- Testes Rápidos para Coronavírus o Que Fazer Na Farmácia - ClinicarxDocument1 pageTestes Rápidos para Coronavírus o Que Fazer Na Farmácia - ClinicarxMarcia NeumannNo ratings yet
- Plano de Aula AlgasDocument7 pagesPlano de Aula AlgasDanielle Diniz GalvãoNo ratings yet
- Alexander FlemingDocument10 pagesAlexander FlemingHCPR100% (1)
- Histologia - HemocipoieseDocument62 pagesHistologia - HemocipoieseMarcelle MarquesNo ratings yet
- Virus e Viroses - 3º Ano - Bio - 01Document58 pagesVirus e Viroses - 3º Ano - Bio - 01Igor CajatyNo ratings yet
- 9 - Resistência Aos AntimicrobianosDocument49 pages9 - Resistência Aos AntimicrobianosJéssica EicheltNo ratings yet
- Importância do Sangue no Equilíbrio do CorpoDocument15 pagesImportância do Sangue no Equilíbrio do CorpoDulce SousaNo ratings yet
- Atividades de Fixação Da Primeira Lei de MendelDocument4 pagesAtividades de Fixação Da Primeira Lei de MendelChiara Cristina Marafon Correia100% (1)
- Sociedade Primitiva PDFDocument20 pagesSociedade Primitiva PDFArquimedes AtlasNo ratings yet
- Sistema ABO e 2a Lei MendelDocument4 pagesSistema ABO e 2a Lei MendelRodolfo LuizNo ratings yet
- 1 Atividade 1 Ano 4 BimestreDocument2 pages1 Atividade 1 Ano 4 Bimestrevalfreefires21No ratings yet
- Ciclos de vida, meiose e alternância de geraçõesDocument2 pagesCiclos de vida, meiose e alternância de geraçõesSem nomeNo ratings yet
- Ecologia humana e sociabilidade urbanaDocument36 pagesEcologia humana e sociabilidade urbanadueduardaNo ratings yet
- Potencial de acción compuesto en nervio ciático de ranaDocument33 pagesPotencial de acción compuesto en nervio ciático de ranaPaoli RuizNo ratings yet
- Reguladores do ciclo celular: ciclinas, Cdks e APC/CDocument6 pagesReguladores do ciclo celular: ciclinas, Cdks e APC/CTúlio HenriqueNo ratings yet
- Farmacocinética e formas de administração de medicamentosDocument59 pagesFarmacocinética e formas de administração de medicamentosnatalia100% (2)
- Origem da Vida - Processos IniciaisDocument10 pagesOrigem da Vida - Processos IniciaisHiago Leite da SilvaNo ratings yet
- O que é Educação FísicaDocument23 pagesO que é Educação FísicaJuan Bueno100% (1)
- As Cinco Leis Biologicas Da Nova Medicina GermanicaDocument28 pagesAs Cinco Leis Biologicas Da Nova Medicina GermanicaGunter Ferreira100% (2)
- Avaliação de Biologia - EjaDocument2 pagesAvaliação de Biologia - EjaBianca Araújo100% (1)
- Ecossistemas e cadeias alimentaresDocument2 pagesEcossistemas e cadeias alimentarestati_lobatto100% (4)
- Evolução das Baratas - Estudo sobre Sobrevivência em Diferentes HabitatsDocument2 pagesEvolução das Baratas - Estudo sobre Sobrevivência em Diferentes Habitatssandrasilvestre702522No ratings yet