Professional Documents
Culture Documents
FINAL Informe 4
Uploaded by
BryanDuqueÁlvarezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
FINAL Informe 4
Uploaded by
BryanDuqueÁlvarezCopyright:
Available Formats
Enlaces Qumicos
David Herrera (1733456); Bryan Duque (1728150); Fernando Zambrano (1729478)
Departamento de Qumica, Universidad del Valle.
Fecha de Realizacin de la prctica: 13 de febrero del 2017
Fecha de Entrega: 3 de abril del 2017
Resumen
Se determin de manera cualitativa la naturaleza de los enlaces de compuestos inicos, covalentes
polares y covalente no polar, a soluciones 0,1% de NaOH, sacarosa, NaCl, agua destilada,
Acetona, NaOH, Cu(NO3)2, HCl, NH4OH, despus se procedi a determinar de manera cualitativa
el tiempo de fusin de NaCl, sacarosa y cera de parafina, finalmente se obtuvieron compuestos de
coordinacin a partir de Cu(NO3)2 y NH4OH y apartir de una sal poco soluble a partir de AgNO 3 y
Datos y clculos:
Tabla 1. Datos obtenidos.
Conductividad elctrica
Liquido Bajo prueba Observacin ( Prende el Bombillo? )
Agua Destilada No Prende
Solucin de NaCl Si Prende
Solucin de Sacarosa No Prende
Solucin de Acetona No Prende
Solucin de NaOH No Prende
Solucin de Cu(NO3)2 Si Prende
Solucin de HCl Si Prende
Punto de Fusin
Sustancia Bajo Prueba Observacin ( Funde?)
Sal Comn (NaCl) Si Funde
Sacarosa Si Funde
Parafina Si Funde
Compuestos de Coordinacin
Soluciones (Acuosas) Observacin
Cu(NO3)2 (ac) + NH3 (ac) Cambio Tonalidad Azulada
AgNO3 (ac) + NaCl (ac) Cambio Tonalidad Blanca
Producto anterior + NH3 (ac) Cambio Tonalidad Transparente
Anlisis y discusin de resultados
La naturaleza de los enlaces qumicos es de algunos de los factores responsables de las
gran importancia en el estudio de las caractersticas fsicas y qumicas de los
reactividad qumica, la estructura, la compuestos, por ejemplo la conductividad
diferencia de electronegatividad, son elctrica, el tipo de enlace ya sea inico,
covalente polar o apolar determina si es un encendi, la acetona o propanona es un
electro fuerte, electrolito dbil, o no electrolito compuesto orgnico, una de la
adems del grado de disociacin que caractersticas de los compuestos de
experimentan en disolucin acuosa, en el esqueleto carbonado es que sus enlaces son
cual generalmente el solvente es agua. En el covalente puro cuya diferencia de
laboratorio se realizo el reconocimiento de la electronegatividad es cero (no polares) o
conductividad elctrica de algunos covalente polar en el caso de tener una
compuestos, para comprobar de manera tomo unido al carbono que produzca en la
cualitativa el tipo de enlace que constituye la molcula un delta de densidad electrnica,
molcula o el compuesto inico, de acuerdo aun generalmente no son buenos
a los resultados de la tabla 1. conductores de electricidad, cabe mencionar
que la acetona no puede formar enlaces e
El agua destilada no es un buen conductor hidrogeno ya que no tiene un tomo de
de electricidad, permite el paso de corriente hidrogeno unido al oxigeno que est presente
dbilmente, como se observ en el en la molcula, el tipo de enlace es covalente
experimento, ya que al carecer de iones, la polar para el tomo de carbono de la mitad,
nica interaccin que hay entre las molculas por lo dicho anteriormente, en la ecuacin 3
son los enlaces de hidrogeno formados por el se observa la acetona diluida en agua.
enlace O-H de la molcula de agua, adems
de su carcter covalente polar(1). + H 2 O H 2 O+ ec. 3
En la solucin de NaCl 0,1% permiti el paso
de corriente y la bombilla alumbro de manera El NaOH es una base fuerte pues se disocia
intensa, una de las caractersticas de las completamente en disolucin en iones Na + y
sales inicas monovalentes es que se iones OH entonces es un electrolito fuerte,
disocian en cationes y aniones, permitiendo en la experimentacin se obtuvo contrario a
el paso de la corriente. La ecuacin 1. lo esperado, la causa pudo haber sido un
Representa la disociacin del cloruro de fallo en el montaje experimental.
sodio en agua, por lo tanto el NaCl es un El NH4OH es otra base que experimenta
electrolito fuerte y la interaccin de estos disociacin en iones en solucin pero es una
iones es de carcter electrosttico, no es base dbil, se espera que permita el paso de
propiamente un enlace como en el caso de corriente pero la luz sea tenue, aun as esto
los compuestos covalentes, en disolucin no ocurri posiblemente por lo discutido con
estos iones estn hidratados por las la solucin de NaOH.
molculas de agua de naturaleza polar.
El HCl en solucin es un cido fuerte que se
l
aq ec .1 disocia completamente en sus iones tal como
N a+ se presenta en la ecuacin 4. En la
aq +C
experimentacin se observ que la luz
NaCl s +agua encendi con intensidad lo que demostr la
En la solucin de azcar el bombillo no gran diferencia de electronegatividad del
encendi, la sacarosa o azcar de mesa es enlace H-Cl. Los cidos fuertes se disocian
un compuesto orgnico que en disolucin por completamente en agua lo que permite que
accin de las molculas de agua vencen las sean buenos conductores de electricidad.
fuerzas intermoleculares (Van der Waals y de
dispersin) del compuesto slido y se
C l aq ec . 4
disuelve, pero no se disocia en iones (no
electrolito) la naturaleza de sus enlaces es
++
covalente y se evidenci de manera HCl + H 2 O H 3 O
experimental, en la ecuacin 2. Se presenta
la frmula de sacarosa y agua. El nitrato de cobre II es una sal divalente, que
en disolucin permite el paso de corriente ya
C12 H 12 O11 + agua C 12 H 12 O11 +agua ec .2 que se disocia en sus iones tal como se ve
s aq
en la ecuacin 5, en la experimentacin el
bombillo encendi moderadamente,
La solucin de acetona tampoco permiti el comparado con las otras soluciones.
paso de corriente por ende el bombillo no
electrones libre para formar el compuesto de
N O3 2 coordinacin, el AgNO3 reacciono con NaCl
formando una sal poco soluble, al reaccionar
aq el AgCl con NH4OH forma un compuesto
coordinado disolvindose el precipitado en
2 N O solucin.
2 +
C uaq +
Cu
La naturaleza de las fuerzas de atraccin Preguntas
entre molculas de un mismo compuesto o la
fuerzas electrosticas en compuestos inicos 2. De los resultados del numeral (1) parte (a)
determinan propiedades fsicas como el del procedimiento, diga cuales son
punto de fusin y el punto de ebullicin las sustancias conductoras y cuales no
cuales pueden ser consideradas como la conductoras y explique por qu. Qu tipo de
cantidad de energa necesaria para superar enlace se presenta en cada sustancia y por
estas fuerzas de atraccin debido a
qu?
vibraciones atmicas o moleculares y
provocar el cambio de estado
correspondiente, el nombre de este tipo de R/: Agua destilada no es buen conductor,
fuerzas intermoleculares, son fuerzas de porque es un enlace polar, no se desprenden
Van der Waals, fuerzas de dispersin de con facilidad los iones, debido a esto se
London, enlaces de hidrogeno (puentes de puede transportar no tiene electrolitos.
hidrogeno) e interacciones de tipo inico (1). NaCl, Cloruro de Sodio es buen conductor,
Las interacciones electrostticas hacen que
porque es un enlace ionico, porque disocian
los slidos inicos tengan un punto de fusin
elevado comparado con compuestos con otro en medio acuoso en el ion cloruro, este se
tipo de enlaces, en la experimentacin se puede mover en la disolucin con mayor
fundi NaCl aproximadamente un 1 g el facilidad campo elctrico, este movimiento
tiempo total fue de 3,25 min muy alto permite paso corriente, al cual cumple la
comparado con el azcar o la parafina, se electrolisis fuerte.
requiere una gran cantidad de energa para Sacarosa, no es un buen conductor porque
vencer esas fuerzas de atraccin inica y
enlace covalente y no se disocia en agua por
producir la fusin. En la sacarosa la fusin
fue muy rpida, esto se explica porque la esto no presenta cargas y no conduce, tal
atraccin molecular estn implicadas fuerzas razn sabemos que no tiene no electrolisis
intermoleculares dbiles, entonces requieren Acetona, al igual ser igual a la sacarosa un
menos energa para fundir el compuesto, la enlace covalente estos casi no presentan una
cera de parafina es un compuesto orgnico, conductividad a lo cual no tiene electrolisis.
de punto de fusin muy bajo comparado con
NaOH, hidrxido de sodio, es buen conductor
los otros dos compuestos que se fundieron,
el tiempo de 20 segundos aproximadamente, de electricidad porque es enlace ionico y se
esto se explica por que la fuerza de atraccin disocia en agua formando en su estado
en sus molculas son las fuerzas de acuoso.
dispersin de London estas fuerzas son muy Cu(NO3)2, nitrato cprico, es buen conductor
dbiles y son las nicas existente en las de electricidad porque es enlace inico y al
molculas con enlaces covalente puro. igual este es una sal que por esto tiene
mayor polarizacin con el agua al ionizarse y
Los compuestos de coordinacin o aductos
segn la teora de cidos y bases de Lewis, estar estado acuoso.
son compuestos en el que una molcula con HCl, el cido clorhdrico, es buen conductor
un par libre los dona a otra o un tomo para de electricidad porque es un forma
formar un enlace. La mezcla de Cu(NO3)2 electrolitos al disociarse con el agua en
forma un compuesto de color azul, el el estado acuoso, es un enlace polar.
nitrgeno del NH4OH dona su par de
sodio, como esto ocurre su reaccin por que
3. De los resultados de numeral (1) parte (b) tiene dos fases al cual es poco soluble.
del procedimiento, diga cual sustancia tardo AgNO 3+ NaCl NaNO3 + AgCl
ms tiempo en fundirse y por qu? pero se vuelve soluble con el compuesto
coordinado hidrxido de amonio produciendo
R/ sal comn, (NaCl), por ser un enlace que sea mas estable la reaccin, al obtener
inico, este tardo ms en fundirse porque su nitrato de plata, se pierde entonces su color y
electronegativa alta, para romper su enlace se vuelve incoloro.
tendra que tener una mayor energa, por lo
cual su punto de fusin y ebullicin muy
NaNO3 + AgCl+ NH 4 OH NH 4 Cl+ AgNO3 + NaOH
altos.
Contrario con la Sacarosa y la parafina, que
6. Escribir dos ejemplos de elementos o
son enlaces covalentes y ademas son
compuestos que contenga enance ionico,
compuestos orgnicos, que tiene mayor
enlaces covalentes no polares, enlaces
facilidad de romper su enlace por eso funde
covalente polares y enlaces covalente
mas rpido y su temperatura de fusin y
coordinados
ebullicin son bajas.
R/
4. De los resultados del numeral (2) parte (a)
NaCl, enlace ionico
del procedimiento, describa sus
MgO, enlace ionico
observaciones y explique lo que sucedi
O2, enlace covalente apolar
mediante ecuacin qumica
CH4, enlace covalente apolar
HCl, enlace covalente polar
R/ la reaccin qumica de nitrato de cobre
NH3 enlace covalente polar
ms con el hidrxido de amonio produjo
SO2 enlace covalente coordinado
hidrxido de cobre y nitrato de amonio con se
H3O+ enlace covalente coordinado
observ este cambio un color de azulado
ms fuerte , por la presencia de hidrxido de
7. represente las estructura de puntales de
cobre.
lewis que muestre los enlaces en un caso
Formo un puente de hidrogeno al cual se
obtuvo esa precipitacin, y el amonio es
a) NaCl, enlace ionico
prueba de este reaccin por enlace
coordinado
Cu ( NO 3 )2 +2 NH 4 OH Cu ( OH )2+ 2 NH 4 NO3 b) MgO, enlace ionico
5. De los resultados del numeral (2) parte (b)
del procedimiento, describa sus
observaciones y explique lo que sucedi
mediante ecuacin qumica
c) O2, covalentes
R/ al reaccionar nitrato de plata con cloruro
de sodio forma cloruro de plata que es una
sal tipo solida y blanca que puede considerar
lechosa, que esta diluida en en nitrato de d) CH4
e) HCl
f) NH3
g) SO2
h) H3O+
Conclusiones.
1. Los enlaces qumicos determinan
caractersticas fsicas y qumicas de
los compuestos.
2. El agua es un solvente adecuado
para hidratar iones y permitir el paso
de corriente.
3. Los cidos, bases fuertes y las sales
son muy buenos conductores de
electricidad.
Bibliografa.
1. Chang, Raymond. Qumica.
Undcima Edicin McGraw-Hill,
2013, Pg. 32, 33, 34, 35.
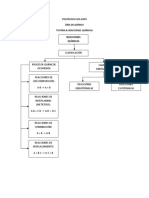
Figura 1. Diagrama de flujo de enlaces
qumicos.
You might also like
- Informe 3 Lab QuímicaDocument4 pagesInforme 3 Lab QuímicaEduar FerrerNo ratings yet
- Informe 2 MVDocument4 pagesInforme 2 MVValeria AmpudiaNo ratings yet
- Enlaces químicos y solubilidadDocument3 pagesEnlaces químicos y solubilidadMiguel Angel Burbano CastilloNo ratings yet
- 2.enlace QuimicoDocument6 pages2.enlace QuimicoChristian David LozanoNo ratings yet
- Laboratorio 3. EnlacesDocument4 pagesLaboratorio 3. EnlacesP. CAMILA ORTIZ GALINDEZNo ratings yet
- Enlaces QuímicosDocument7 pagesEnlaces QuímicosLaura Valentina RodriguezNo ratings yet
- EnlacesQuímicosDocument5 pagesEnlacesQuímicosHeRnan AnTonyo ChapidNo ratings yet
- Informe #3 Enlaces QuímicosDocument6 pagesInforme #3 Enlaces QuímicosEsmeralda AlvarezNo ratings yet
- Laboratorio Quimica 5Document4 pagesLaboratorio Quimica 5sawyerch100% (7)
- Informe Enlace QuimicoDocument7 pagesInforme Enlace QuimicoValentina HrNo ratings yet
- Práctica 4 - Enlace QuímicoDocument4 pagesPráctica 4 - Enlace QuímicoJoseMorilloNo ratings yet
- 4 QUIMICA 1. REACCIONES EN DISOLUCION ACUOSA UltimaDocument72 pages4 QUIMICA 1. REACCIONES EN DISOLUCION ACUOSA UltimaKarla JaramilloNo ratings yet
- Informe 3 (Para Corrección) EnlacesDocument4 pagesInforme 3 (Para Corrección) EnlacesCarlos LoaizaNo ratings yet
- Enlaces Químicos - Lab 3Document7 pagesEnlaces Químicos - Lab 3SEBASTIAN VARGAS MU�OZNo ratings yet
- Enlaces QuimicosDocument6 pagesEnlaces QuimicosBrendaMurilloNo ratings yet
- Enlace QuimicoDocument5 pagesEnlace QuimicoCarlos Manuel Bahos ChaguendoNo ratings yet
- Informe 3 Lab Quimica UnivalleDocument5 pagesInforme 3 Lab Quimica Univallejuanpis100% (2)
- Enlaces Quimicos Practica#3Document6 pagesEnlaces Quimicos Practica#3Sara DoradoNo ratings yet
- Enlace Químico.Document3 pagesEnlace Químico.jennyfer castrillonNo ratings yet
- Análisis de Resultados NDocument6 pagesAnálisis de Resultados NAndres SernaNo ratings yet
- Determinación de enlaces químicos mediante conductividad eléctricaDocument9 pagesDeterminación de enlaces químicos mediante conductividad eléctricaJohn PujayNo ratings yet
- Informe Enlaces Quimicos.Document8 pagesInforme Enlaces Quimicos.Alejandra Zea100% (1)
- Enlaces QuimicosDocument4 pagesEnlaces QuimicosJose Gabriel Barreiro CastañoNo ratings yet
- Práctica 1 Electrolisis - Eq#1Document17 pagesPráctica 1 Electrolisis - Eq#1Ramos Carpio RosarioNo ratings yet
- Guía de Química Luis DavidDocument6 pagesGuía de Química Luis DavidMaria VictoriaNo ratings yet
- Capitulo 1 - Ecuaciones IonicasDocument7 pagesCapitulo 1 - Ecuaciones IonicasWendy Torres GonzalezNo ratings yet
- Qca-Enlace Químico. M-CDocument6 pagesQca-Enlace Químico. M-CMau MauNo ratings yet
- Químicos EnlacesDocument10 pagesQuímicos Enlacesイ乇イ乇 ズののNo ratings yet
- Equilibrios ácido-base: teoría de la disociación iónica y reacciones ácido-baseDocument29 pagesEquilibrios ácido-base: teoría de la disociación iónica y reacciones ácido-basetatiana8garijoNo ratings yet
- Informe Laboratorio Quimica General-Enlace QuimicoDocument4 pagesInforme Laboratorio Quimica General-Enlace QuimicoBryan RekaldeNo ratings yet
- ResumenDocument3 pagesResumenViviana BolañosNo ratings yet
- Informe Pos-Laboratorio Pract 3Document13 pagesInforme Pos-Laboratorio Pract 3Isabel VilchezNo ratings yet
- LAB 3. Enlaces QuimicosDocument3 pagesLAB 3. Enlaces QuimicosSara HernandezNo ratings yet
- Disoluciones iónicas y reacciones de precipitaciónDocument32 pagesDisoluciones iónicas y reacciones de precipitaciónNivelo SaidNo ratings yet
- Teoria y Resultados Practica3Document6 pagesTeoria y Resultados Practica3yulloubeihouppa-2682No ratings yet
- Reacciones en disolución acuosaDocument3 pagesReacciones en disolución acuosaandrea jimenezNo ratings yet
- Informe 6-7 Serie de Actividad de Los Metales - Disoluciones Que Conducen ElectricidadDocument5 pagesInforme 6-7 Serie de Actividad de Los Metales - Disoluciones Que Conducen ElectricidadCaro75% (8)
- Enlaces Moleculares (Lab Oratorio)Document11 pagesEnlaces Moleculares (Lab Oratorio)api-3802973100% (3)
- Reacciones químicas de complejosDocument4 pagesReacciones químicas de complejosAndrés DelgadoNo ratings yet
- Enlace QuimicoDocument7 pagesEnlace Quimicobonacera nonNo ratings yet
- Informe Lab Quimica Enlace QuimicoDocument7 pagesInforme Lab Quimica Enlace QuimicoJuan camilo chantre andradeNo ratings yet
- Informe Quimica 2Document5 pagesInforme Quimica 2Carlos Felipe EugenioNo ratings yet
- Informe Enlaces Quimicos!Document5 pagesInforme Enlaces Quimicos!Daniel HernándezNo ratings yet
- Quimica ContinentalDocument3 pagesQuimica ContinentalLeiver Ricardo Pastor100% (1)
- Reacciones Quc3admicasDocument4 pagesReacciones Quc3admicasDulce María Ruiz LoraNo ratings yet
- Inf - Lab 6 Enlaces QuimicosDocument10 pagesInf - Lab 6 Enlaces QuimicosJoana VilladaNo ratings yet
- ElectronegatividadDocument7 pagesElectronegatividadGinet Tatiana Alvarez VictoriaNo ratings yet
- InformeDocument5 pagesInformeJuliana Salcedo JaramilloNo ratings yet
- Guia de Practica - Lab 7 - 8Document14 pagesGuia de Practica - Lab 7 - 8Jhon Paul SanchezNo ratings yet
- Enlace químico y sus propiedadesDocument5 pagesEnlace químico y sus propiedadesMayra Alexandra Urquiaga MezaNo ratings yet
- Análisis Elemental de Comp OrgánicosDocument8 pagesAnálisis Elemental de Comp Orgánicostahia silveraNo ratings yet
- Lara Mata Arturo P6Document10 pagesLara Mata Arturo P6イ乇イ乇 ズののNo ratings yet
- Experiencia NDocument6 pagesExperiencia NJohnjairo Edu Romero EspinoNo ratings yet
- Informe de Laboratorio #11Document15 pagesInforme de Laboratorio #11Maria NavasNo ratings yet
- Práctica #6. Enlace Químico y ConductividadDocument5 pagesPráctica #6. Enlace Químico y ConductividadDanuil MorenoNo ratings yet
- Experimento sobre la conductividad eléctrica de compuestos iónicos y covalentesDocument13 pagesExperimento sobre la conductividad eléctrica de compuestos iónicos y covalentesLeer A lotNo ratings yet
- Informe #9-Química General A2Document35 pagesInforme #9-Química General A2Andres Arturo Lee Sanchez Castillo63% (19)
- Efecto Del Ion ComúnDocument1 pageEfecto Del Ion ComúnBryanDuqueÁlvarezNo ratings yet
- Síntesis 2,6-dibenciliden-ciclohexanonaDocument7 pagesSíntesis 2,6-dibenciliden-ciclohexanonaBryanDuqueÁlvarezNo ratings yet
- Simetría 2Document1 pageSimetría 2BryanDuqueÁlvarezNo ratings yet
- Caso de Uso y Diagrama de ClasesDocument2 pagesCaso de Uso y Diagrama de ClasesBryanDuqueÁlvarezNo ratings yet
- REVIEWDocument3 pagesREVIEWBryanDuqueÁlvarezNo ratings yet
- Determinación Tecnologias de HardwareDocument1 pageDeterminación Tecnologias de HardwareBryanDuqueÁlvarezNo ratings yet
- ProolouridadDocument5 pagesProolouridadBryanDuqueÁlvarezNo ratings yet
- Como ReferenciasDocument2 pagesComo ReferenciasBryanDuqueÁlvarezNo ratings yet
- NIRSDocument2 pagesNIRSBryanDuqueÁlvarezNo ratings yet
- Resumen Teoria y PrácticaDocument1 pageResumen Teoria y PrácticaBryanDuqueÁlvarezNo ratings yet
- FORO Desafios en El Modelamiento ConceptualDocument2 pagesFORO Desafios en El Modelamiento ConceptualBryanDuqueÁlvarezNo ratings yet
- Actividad Motricidad FinaDocument2 pagesActividad Motricidad FinaBryanDuqueÁlvarezNo ratings yet
- Entregable 4Document1 pageEntregable 4BryanDuqueÁlvarezNo ratings yet
- Foro - Derechos de AutorDocument1 pageForo - Derechos de AutorBryanDuqueÁlvarezNo ratings yet
- Matriz Dofa EmprendimientoDocument2 pagesMatriz Dofa EmprendimientoBryanDuqueÁlvarezNo ratings yet
- Taller Usabilidad EticaDocument6 pagesTaller Usabilidad EticaBryanDuqueÁlvarezNo ratings yet
- SenainformacionDocument3 pagesSenainformacionCarlos Betancourt0% (1)
- Actividad 3 ForoDocument2 pagesActividad 3 ForoBryanDuqueÁlvarezNo ratings yet
- Libro 1Document2 pagesLibro 1BryanDuqueÁlvarezNo ratings yet
- Estefania TrochezDocument2 pagesEstefania TrochezBryanDuqueÁlvarezNo ratings yet
- Parcial Ética IDocument2 pagesParcial Ética IBryanDuqueÁlvarezNo ratings yet
- EticaDocument3 pagesEticaBryanDuqueÁlvarezNo ratings yet
- Normas Apa Revisada y Actualizada Mayo 2019Document26 pagesNormas Apa Revisada y Actualizada Mayo 2019JOHAN FERNANDO QUIROZ SERNAQUE80% (5)
- Escuelas ÉticasDocument1 pageEscuelas ÉticasBryanDuqueÁlvarezNo ratings yet
- Gestión Ambiental EstatalDocument2 pagesGestión Ambiental EstatalBryanDuqueÁlvarez100% (1)
- Analisis DetergentesDocument26 pagesAnalisis DetergentesBryanDuqueÁlvarez100% (1)
- Preguntas de Escuelas Tipo Icfes - para ImprimirDocument1 pagePreguntas de Escuelas Tipo Icfes - para ImprimirBryanDuqueÁlvarezNo ratings yet
- Ejercicios Propuestos Tema 1Document7 pagesEjercicios Propuestos Tema 1sofiNo ratings yet
- Modelo de Resumen IVCCEQ2020REVDocument1 pageModelo de Resumen IVCCEQ2020REVBryanDuqueÁlvarezNo ratings yet
- Taller de Repaso Parcial IiDocument8 pagesTaller de Repaso Parcial IiBryanDuqueÁlvarezNo ratings yet
- IP053 - Examen de La Gestion de La Contaminacion AtmosfericaDocument8 pagesIP053 - Examen de La Gestion de La Contaminacion AtmosfericaMartin Serres100% (1)
- Solucionario de QuimicaDocument5 pagesSolucionario de Quimicaana luciaNo ratings yet
- Trabajo Individual 2FDocument10 pagesTrabajo Individual 2FSalvador CruzNo ratings yet
- UNIDAD III, IV y VDocument10 pagesUNIDAD III, IV y VenocNo ratings yet
- Introduccion El AsfaltoDocument21 pagesIntroduccion El AsfaltoMoises AF67% (3)
- PastorinoDocument170 pagesPastorinoRafael Armando ZaldañaNo ratings yet
- Método PCA diseño espesores losas hormigónDocument177 pagesMétodo PCA diseño espesores losas hormigónvictor luis100% (1)
- Aire Acondicionado de La Zota Huiza MaquinariaDocument22 pagesAire Acondicionado de La Zota Huiza MaquinariaJimmy Mayta MamaniNo ratings yet
- 5 Ejemplo de Método CientíficoDocument6 pages5 Ejemplo de Método CientíficoSamuel Brenda Ordoñez50% (2)
- Movimiento Rectilineo UniformeDocument4 pagesMovimiento Rectilineo UniformeSteffy Salas OrozcoNo ratings yet
- Transferencia CalorDocument19 pagesTransferencia CalorPaul MoralesNo ratings yet
- Ensayo Normas MaderaDocument5 pagesEnsayo Normas MaderaDNo ratings yet
- Numero de Reynolds WikiDocument3 pagesNumero de Reynolds WikiMiguelNo ratings yet
- Diseño de Losas Macizas en 02 Direcciones - Método de La NTP E PDFDocument9 pagesDiseño de Losas Macizas en 02 Direcciones - Método de La NTP E PDFNiltonWilfredoDelgadilloAlanyaNo ratings yet
- CC Cables EléctricosDocument7 pagesCC Cables EléctricosRAPHAEL DIAZ REVILLANo ratings yet
- Ejercicios de Configuracion Electronica y TPDocument3 pagesEjercicios de Configuracion Electronica y TPJusten AnthonyNo ratings yet
- K-CC2-170-CONST-INF-025 - RB - EDW PoliclínicoDocument40 pagesK-CC2-170-CONST-INF-025 - RB - EDW PoliclínicoW.N. Ricci S.No ratings yet
- 3560900255183UTFSMDocument129 pages3560900255183UTFSMJhon Nilton Borda ApazaNo ratings yet
- Practica 1 Deter Humedad GranoDocument8 pagesPractica 1 Deter Humedad GranojhoswelinNo ratings yet
- AIREDocument15 pagesAIRECASIMIRA BENITES MONTALVONo ratings yet
- Permeabilidad CelularDocument18 pagesPermeabilidad CelularLuis PerezNo ratings yet
- Sistemas Aguas-Parámetros-DosificaciónDocument2 pagesSistemas Aguas-Parámetros-DosificaciónCesar RiscoNo ratings yet
- Guia Enlace. SolucionarioDocument14 pagesGuia Enlace. SolucionarioConstanza Baquedano GonzálezNo ratings yet
- TEMA 5. - Electroquímica PDFDocument31 pagesTEMA 5. - Electroquímica PDFmatina14No ratings yet
- Enlaces Quimica InorganicaDocument18 pagesEnlaces Quimica InorganicaRuth WikiNo ratings yet
- At Mo de Hidr Geno e Hidrogenoideos PDFDocument40 pagesAt Mo de Hidr Geno e Hidrogenoideos PDFDiego PérezNo ratings yet
- Documentos ETS ORD ENERO16 IQPDocument2 pagesDocumentos ETS ORD ENERO16 IQPZabellzaroch GerdenheimNo ratings yet
- Tema2 EnlaceAtomicoDocument47 pagesTema2 EnlaceAtomicoMabel Pezo MeléndezNo ratings yet
- 1BACH - Circuitos Neumáticos e HidráulicosDocument28 pages1BACH - Circuitos Neumáticos e Hidráulicosjeferson copete mosqueraNo ratings yet
- Ingeniería de MaterialesDocument143 pagesIngeniería de MaterialesIsai RosasNo ratings yet