Professional Documents
Culture Documents
Estructura Atómica
Uploaded by
Nelson Berrios0 ratings0% found this document useful (0 votes)
98 views1 pageRESUMEN SINTÉTICO
Original Title
ESTRUCTURA ATÓMICA
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentRESUMEN SINTÉTICO
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
98 views1 pageEstructura Atómica
Uploaded by
Nelson BerriosRESUMEN SINTÉTICO
Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 1
INSTITUCIÓN EDUCATIVA CRISTIANA
QUÍMICA
“FLEMING COLLEGE” Nelson F. Berrios Estela
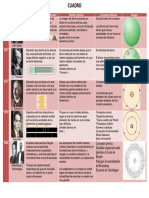
ESTRUCTURA ATÓMICA
1. TEORÍA ATÓMICA DE J. DALTON (1808)
Fue el que dio carácter
científico al átomo.
El átomo es la mínima porción
de materia compacta,
indivisible e indestructible.
2. TEORÍA ATÓMICA DE THOMPSON (1897)
Según su modelo, el átomo
es una masa homogénea
positiva, y que contiene
incrustados a los electrones. Se esperaba que las partículas atraviezen
(Pastel con pasas). libremente; no obstante, una porción se
desviaba y otra “rebotaba”
El átomo es eléctricamente 4. LOS SALTOS CUÁNTICOS DE BOHR (1913)
neutro, donde la suma de Tomando como referencia la
cargas negativas es igual a la carga positiva de la teoría cuántica de Planck (su
masa (aún no se descubría el protón). profesor) y el modelo atómico
Hizo experimentos con los rayos catódicos, en de Rutherford, explica los
donde descubre a los electrones. espectros del átomo de
hidrógeno. Por lo cual es
3. MODELO ATÓMICO DE RUTHERFORD(1909) aplicable solo a especies
Bombardea una lámina muy hidrogenoides.
delgada de placa de oro, con
partículas de α (partículas El electrón se encuentra girando a alta velocidad
completamente ionizadas-sin alrededor del núcleo en
electrones, de carga positiva), órbitas circulares concén-
observando que solo algunas tricas, denominadas niveles
rebotan o se desvían. Esto lo estacionarios de energía.
lleva a pensar que el átomo tiene un núcleo pesado
de carga positiva. Descubre los protones. El electrón tiene energía
constante.
Plantea su modelo atómico 5. MODELO ATÓMICO DE SOMMERFELD (1915)
como un Sistema planetario Introduce el concepto de
en miniatura. subnivel de energía al señalar
que a partir del segundo nivel
de energía, algunos
electrones desarrollan órbitas
Experimento de Rutherford elípticas, corrigiendo a Niels
Bohr .
You might also like
- Teoria AtomicaDocument3 pagesTeoria AtomicaNeheyler MecatrónicoNo ratings yet
- Modelos HistoricosDocument10 pagesModelos HistoricosSusana ChicasNo ratings yet
- XX - Copia de 4 - Quimica II 1roDocument29 pagesXX - Copia de 4 - Quimica II 1roRenzo AntonioNo ratings yet
- Modelos atómicosDocument6 pagesModelos atómicosAngrySquirl 24No ratings yet
- Tarea Evidencias de Estructura AtómicaDocument5 pagesTarea Evidencias de Estructura Atómicaalanntorres09ctrlNo ratings yet
- 04 AtomoDocument36 pages04 AtomoEdward Oblitas ZevallosNo ratings yet
- Modelos atómicos y estructura del átomoDocument5 pagesModelos atómicos y estructura del átomoAngrySquirl 24No ratings yet
- Quimica - 4 ToDocument5 pagesQuimica - 4 ToVictor Huerta RojasNo ratings yet
- Guía N°3 - Módelo y Estructura AtómicaDocument5 pagesGuía N°3 - Módelo y Estructura AtómicaAngrySquirl 24No ratings yet
- Química PREDocument4 pagesQuímica PREVictor Huerta RojasNo ratings yet
- Guia Teoria Atomica 8° BASICODocument7 pagesGuia Teoria Atomica 8° BASICOAnonymous PShSARDzgYNo ratings yet
- Historia Del AtomoDocument15 pagesHistoria Del Atomoisaac luna cañete100% (1)
- Estructura de La MateriaDocument26 pagesEstructura de La MateriaElda Orellana0% (1)
- MÓDULO 2 - Fundamentos de QuímicaDocument52 pagesMÓDULO 2 - Fundamentos de Químicajose.torres1No ratings yet
- ModelosDocument3 pagesModelosricky hernandezNo ratings yet
- Modelos atómicos clave en la historia de la físicaDocument2 pagesModelos atómicos clave en la historia de la físicaRichard Qvispe CNo ratings yet
- Química 2 Guia 1Document16 pagesQuímica 2 Guia 1Alexander GustavoNo ratings yet
- Morado y Verde Animado Patrón Abstracto Proyecto de Grupo Presentación de EducaciónDocument16 pagesMorado y Verde Animado Patrón Abstracto Proyecto de Grupo Presentación de EducaciónIVANNA VERA HUERTANo ratings yet
- El Átomo_ su historia y estructuraDocument8 pagesEl Átomo_ su historia y estructuraEmilio RaschiaNo ratings yet
- Fy Q El Atomo Adrian 3 EsoDocument13 pagesFy Q El Atomo Adrian 3 EsoMARINo ratings yet
- Modelos AtómicosDocument9 pagesModelos Atómicosnatalia chendNo ratings yet
- Teoría AtómicaDocument5 pagesTeoría AtómicaPercy PérezNo ratings yet
- 04 - 2023-IIQ - Teoría Atomica .Document14 pages04 - 2023-IIQ - Teoría Atomica .Melisa CroceNo ratings yet
- El ÁtomoDocument16 pagesEl ÁtomoAndrea MolinaNo ratings yet
- Linea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralADocument2 pagesLinea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralAYurisell NietoNo ratings yet
- Q I 5 SES N 04 Modelos AtomicosDocument5 pagesQ I 5 SES N 04 Modelos AtomicosAndrés Anibal Alca AlvarezNo ratings yet
- Introducción A La Química 1. - Modelos AtómicosDocument5 pagesIntroducción A La Química 1. - Modelos AtómicosholaNo ratings yet
- Guia N°0 REPASO MODELOS ATOMICOSDocument8 pagesGuia N°0 REPASO MODELOS ATOMICOSpiratacoquiNo ratings yet
- Guía I Modelos AtómicosDocument9 pagesGuía I Modelos AtómicosAngélica RamírezNo ratings yet
- Modelo atómico cuánticoDocument8 pagesModelo atómico cuánticoBryan Alejandro Sandoval GarciaNo ratings yet
- LMy TDocument6 pagesLMy Tlu pnNo ratings yet
- Modelo AtomicosDocument2 pagesModelo AtomicosRomell CardenasNo ratings yet
- Estructura de La Materia 2018Document82 pagesEstructura de La Materia 2018samioNo ratings yet
- Lineadeltiempo1 151008043559 Lva1 App6892Document1 pageLineadeltiempo1 151008043559 Lva1 App6892Victor Manuel Macias OrtizNo ratings yet
- Presentación1 Linea de TiempoDocument1 pagePresentación1 Linea de Tiempoluis zavala (luisito)No ratings yet
- Modelos AtomicosDocument6 pagesModelos Atomicosariana fernandezNo ratings yet
- 711 Guia 1 Modelos AtómicosDocument2 pages711 Guia 1 Modelos AtómicosMaria CarrilloNo ratings yet
- Trabajo Modelos Atómicos Grupo 3Document3 pagesTrabajo Modelos Atómicos Grupo 3Lorenzo Es SaNo ratings yet
- Copia de Dalton-Modelos Atómicos-Descubrimiento Partículas ElementalesDocument7 pagesCopia de Dalton-Modelos Atómicos-Descubrimiento Partículas ElementalesmarionetadetrapoNo ratings yet
- Teoria AtomicaDocument6 pagesTeoria AtomicaAnthonyNo ratings yet
- Quimica Semana 03 - 2021 IiiDocument5 pagesQuimica Semana 03 - 2021 IiiDavid LlontopNo ratings yet
- El AtomoDocument35 pagesEl AtomoAlejandro Torrano LopezNo ratings yet
- Apuntes Extra Modelos EnlacesDocument12 pagesApuntes Extra Modelos EnlacesLucia Jimenez AlvarezNo ratings yet
- Modelo atómico de Bohr y espectros atómicosDocument36 pagesModelo atómico de Bohr y espectros atómicosnikika1No ratings yet
- Qui MicaDocument235 pagesQui MicaJupiter GonzalezNo ratings yet
- Semana 1 Estructura AtómicaDocument63 pagesSemana 1 Estructura AtómicaEdder Daga RiveraNo ratings yet
- Modelos AtómicosDocument1 pageModelos AtómicosEMMA MARGARITA TORRESNo ratings yet
- Cuadro Comparativo de Los Modelos AtomicosDocument1 pageCuadro Comparativo de Los Modelos Atomicoslautarobre10No ratings yet
- Bohr SommerfeldDocument10 pagesBohr SommerfeldXimenaNo ratings yet
- Modelo Atomico 1Document3 pagesModelo Atomico 1saratejedorgilNo ratings yet
- Guía N°3 - Módelo y Estructura AtómicaDocument6 pagesGuía N°3 - Módelo y Estructura AtómicaAngrySquirl 24No ratings yet
- Estructura AtomicaDocument39 pagesEstructura AtomicaJESUS ROLANDO FIGUEROA CAMPANANo ratings yet
- 3ºA Carazas Linea de Tiempo AtomoDocument26 pages3ºA Carazas Linea de Tiempo AtomoAmparo Rodriguez0% (1)
- Guia 1 Estructura AtomicaDocument12 pagesGuia 1 Estructura AtomicaMaría TemucoNo ratings yet
- Trabajo Exposicion Grupo 3Document5 pagesTrabajo Exposicion Grupo 3Jesus David PerezNo ratings yet
- QUIMICADocument6 pagesQUIMICARANDY VARAGSNo ratings yet
- Mi Clase - Teoría y Modelos AtómicosDocument22 pagesMi Clase - Teoría y Modelos AtómicosDavid SysNo ratings yet
- Modelos Del AtomoDocument2 pagesModelos Del Atomocamiv14ygNo ratings yet
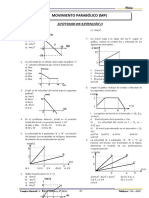
- Cinemática - Parábola-IvDocument1 pageCinemática - Parábola-IvNelson BerriosNo ratings yet
- Cinemática - Parábola-IiiDocument1 pageCinemática - Parábola-IiiNelson Berrios100% (1)
- Física Cinemática Mru IIIDocument1 pageFísica Cinemática Mru IIINelson BerriosNo ratings yet
- Física - Cinemática Mru IDocument1 pageFísica - Cinemática Mru INelson BerriosNo ratings yet
- Cinemática - Parábola-IiDocument1 pageCinemática - Parábola-IiNelson BerriosNo ratings yet
- Física - Cinemática - Mru - CampoDocument1 pageFísica - Cinemática - Mru - CampoNelson BerriosNo ratings yet
- Física - Cinemática-Mruv - IDocument1 pageFísica - Cinemática-Mruv - INelson BerriosNo ratings yet
- Cinemática - Parábola-IDocument1 pageCinemática - Parábola-INelson BerriosNo ratings yet
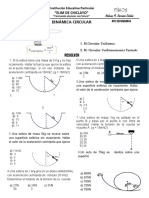
- Cinemática circular: velocidad angular, velocidad lineal y aceleraciónDocument3 pagesCinemática circular: velocidad angular, velocidad lineal y aceleraciónNelson BerriosNo ratings yet
- Física Cinemática Mru IIDocument1 pageFísica Cinemática Mru IINelson BerriosNo ratings yet
- Física Cinemática Mru IIDocument1 pageFísica Cinemática Mru IINelson BerriosNo ratings yet
- Física Cinemática Mru IIIDocument1 pageFísica Cinemática Mru IIINelson BerriosNo ratings yet
- Dinámica Circular 4º .Document1 pageDinámica Circular 4º .Nelson BerriosNo ratings yet
- Dinamica Lineal 4ºDocument1 pageDinamica Lineal 4ºNelson BerriosNo ratings yet
- Antifungico, Hoy AyerDocument12 pagesAntifungico, Hoy AyermedicinahumaNo ratings yet
- FISICADocument11 pagesFISICARonald Luis Paz LopezNo ratings yet
- La Hidrofobicidad de La Superficie Celular Como Indicador de Otros FactoresDocument5 pagesLa Hidrofobicidad de La Superficie Celular Como Indicador de Otros FactoresNelson BerriosNo ratings yet
- Estructura Atómica - PrácticaDocument1 pageEstructura Atómica - PrácticaNelson BerriosNo ratings yet
- Problemas Resueltos de de BroglieDocument8 pagesProblemas Resueltos de de Broglieolga0% (1)
- Sistema respiratorioDocument17 pagesSistema respiratorioPaola Taboada Ponce81% (16)
- ESTUDIO DE COLONIZACIÓN ORAL POR CandidaDocument1 pageESTUDIO DE COLONIZACIÓN ORAL POR CandidaNelson BerriosNo ratings yet
- Práctica de OxidosDocument2 pagesPráctica de OxidosNelson BerriosNo ratings yet
- NeumoDocument2 pagesNeumoNelson BerriosNo ratings yet
- PROTEINASAS EN DIFERENTES ESPECIES DEL GENERO CandidaDocument1 pagePROTEINASAS EN DIFERENTES ESPECIES DEL GENERO CandidaNelson BerriosNo ratings yet
- Malani y Kauffman 2007 Candida ITU TratamientoDocument2 pagesMalani y Kauffman 2007 Candida ITU TratamientoNelson BerriosNo ratings yet
- Masones ChiclayoDocument9 pagesMasones ChiclayoNelson BerriosNo ratings yet
- Candida - FACTORES DE PATOGENICIDADDocument1 pageCandida - FACTORES DE PATOGENICIDADNelson BerriosNo ratings yet
- Preservación de Hongos FilamentososDocument3 pagesPreservación de Hongos FilamentososAldo Ivan QsNo ratings yet
- Preservación de Hongos FilamentososDocument3 pagesPreservación de Hongos FilamentososAldo Ivan QsNo ratings yet
- Guia 6 de QuimicaDocument5 pagesGuia 6 de QuimicaLuis MartinezNo ratings yet
- Taller 6 - Modelos Atómicos - 10ºDocument2 pagesTaller 6 - Modelos Atómicos - 10ºWendy Rodriguez0% (1)
- Antecedentes Del Modelo AtómicoDocument2 pagesAntecedentes Del Modelo AtómicoDiego Flores100% (1)
- El Maestro de Lo Infinitamente PequeñoDocument16 pagesEl Maestro de Lo Infinitamente PequeñoFernando ParraNo ratings yet
- Guía 1 Ciencias 7 Estructura de La Materia 2021Document41 pagesGuía 1 Ciencias 7 Estructura de La Materia 2021Natalia Cruz Varón100% (2)
- La química, estudio en expansión de moléculasDocument41 pagesLa química, estudio en expansión de moléculasAngel CondoriNo ratings yet
- Estructura Atomica IDocument4 pagesEstructura Atomica IJhonÑontolNo ratings yet
- Curso de Electricidad DomiciliariaDocument31 pagesCurso de Electricidad DomiciliariaRojel FernandoNo ratings yet
- Guia 02 EstructuraAtomicaDocument7 pagesGuia 02 EstructuraAtomicaWilliam HernandezNo ratings yet
- ListoDocument30 pagesListoEdward TorresNo ratings yet
- Cuadro Comparativo y Mapa Conceptual de La Teoría AtómicaDocument3 pagesCuadro Comparativo y Mapa Conceptual de La Teoría AtómicaStiven RiveraNo ratings yet
- Unidad 1 Modelos Atomicos 2017Document72 pagesUnidad 1 Modelos Atomicos 2017JorgeNo ratings yet
- Informe 2Document5 pagesInforme 2AldahirHugoCharaRojasNo ratings yet
- Quimica GeneralDocument15 pagesQuimica GeneralDominic BolivarNo ratings yet
- Historia Del ÁtomoDocument3 pagesHistoria Del ÁtomoLourdes Garza100% (1)
- Contenido Tematico 14 Semanas Primera Oportunidad RaimondiDocument3 pagesContenido Tematico 14 Semanas Primera Oportunidad RaimondijackNo ratings yet
- Los Modelos Atomicos y Su HistoriaDocument5 pagesLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaNo ratings yet
- Taller #4 Estructura de La Materia LooDocument3 pagesTaller #4 Estructura de La Materia LooAlfredo LooNo ratings yet
- Talle #6 QuimicaDocument5 pagesTalle #6 QuimicaELMER MIGUEL ARIAS ACOSTANo ratings yet
- Sesion 2-1 Estructura AtomicaDocument40 pagesSesion 2-1 Estructura Atomicachristianpe1No ratings yet
- 02 - Teoria Atomica - CepreDocument6 pages02 - Teoria Atomica - Ceprerenejusto13No ratings yet
- Linea de Tiempo Modelos AtomicosDocument1 pageLinea de Tiempo Modelos Atomicossterek gives me life50% (2)
- Taller No 1 de Estructura AtomicaDocument3 pagesTaller No 1 de Estructura AtomicaGabriela Moncayo PintoNo ratings yet
- ATOMOSDocument10 pagesATOMOSPamela PalominoNo ratings yet
- Copia de Copia de Copia de QuimicaDocument6 pagesCopia de Copia de Copia de Quimicaaneth0205hotmail.comNo ratings yet
- Modelos atómicos a través de la historiaDocument2 pagesModelos atómicos a través de la historiaAngélica R.No ratings yet
- Práctica #2 Ley de Las Proporciones MúltiplesDocument3 pagesPráctica #2 Ley de Las Proporciones MúltiplesAna Fernanda JáureguiNo ratings yet
- QuimicaIII 22ADocument79 pagesQuimicaIII 22Azxcvuno4307No ratings yet
- Extraordinario 2023 CienciasDocument7 pagesExtraordinario 2023 Cienciasneweduar4160No ratings yet
- Línea Del Tiempo de Los Modelos AtómicosDocument14 pagesLínea Del Tiempo de Los Modelos AtómicosGio Andrés HernándezNo ratings yet