Professional Documents
Culture Documents
Qui Semi7 2011-II
Uploaded by
enrrique UCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Qui Semi7 2011-II
Uploaded by
enrrique UCopyright:
Available Formats
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA
CENTRO DE ESTUDIOS PREUNIVERSITARIOS
SEMINARIO FINAL DE QUÍMICA
UNIDAD 15.
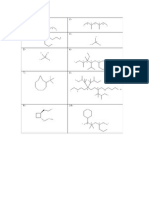
COMPUESTOS OXIGENADOS 5. Indicar el nombre de cada uno de los
siguientes compuestos:
1. El nombre del compuesto cuya estructura se
muestra es: Nº Fórmula
CH3 – CH – CH = C– CH – CH3 CH3
| |
CH3 OH 1º
CH3 – CH – CH2OH
A) 5 – metil – 3 – hexen – 3 - ol
B) 2 – metil – 3 – hexen – 4 – ol
C) 1 – metil – 3 – hexen – 4-ol 2º OH
D) 3 – metil – 2 – butenol – 3 - eno OH
E) 3 – hidroxi – 5 – metil – 3 – hexeno
Cl
2. El nombre IUPAC de la siguiente estructura es: I
CH3- CH-CH-CH=CH-CH2-COOH
3º
I
CH3
O O
A) 3- ona-2- penteno 4º
B) 3- pentenona-2-eno
C) 3-penten-2-ona CH3
D) 4 pentona-3-eno |
E) 4 ceto-2- pentenona 5° CHO − CH = C − CHO
3. ¿Cuál es el nombre de la siguiente O O
estructura?: 6 I| I|
O O CH3 − C − O − C − CH2− CH2− CH3
7º CH3CH2-O-CH2-CH3
A) Pentanoato de propilo
B) Acido 3-butil butanoico 8º CH3-CO-CO-CH3
C) 3-propilpentadiona
D) Isopropilpropanona
CH3-CH=CH- CH2-CHO
E) 3-propilpentanodial
I
9º OH
4. La oxidación (con permanganato de potasio u
óxido crómico)del 1-cloro-2-pentanol produce:
A) 1-cloropentanal
B) ácido 1-cloropentanoico
C) 1-cloro-2-pentanona
D) No se oxida 10°
E) éter clorodimetílico
CEPRE-UNALM 1 CICLO REGULAR 2011 – II
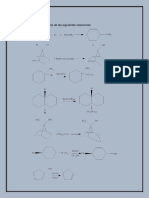
6.¿Cuáles son los productos de las siguientes 11. Respecto a los nombres comunes la relación
reacciones? correcta es:
a) Reacción de esterificación A) etanol : alcohol metílico
CH3-CH2-CH2OH+ CH3-COOH B) propanona : acetona
……………………………………………………………………. C) ácido etanoico : ácido fórmico
D) ácido metanoico : ácido acético
b) Reacción de deshidratación de los ácidos E) propanodiol : glicerol
carboxílicos
CH3-COOH + CH3COOH 12. Respecto a la estructura:
…………………………………………..…. CH2OH
c) Reacción de formación de éteres
CH3CH2OH + OHCH2-CH3
………………………………………………
A) Su formula global es C7H9O
B) Es un compuesto que pertenece a la
7. En la reacción de hidratación del propeno se
familia de los fenoles
forma:
C) La molécula tiene seis carbonos con
A) CH3 – CH2 – CH3
hibridación sp2
B) CH3 – CHOH – CH3
D) Es un aldehído
C) CH3 – CH2 –CHO
E) Es un hidrocarburo insaturado
D) CH C – CH3
E) CH2OH – CHOH – CH3
UNIDAD 16. COMPUESTOS NITROGENADOS
8. La fórmula del etanoato de etilo, es: 13. La fórmula de la etanamina( o etilamina) es:
A) H COO CH2 CH3 A) C2H6N
B) CH3 CO CH2 CH3 B) C2H8N2
C) CH3 COO CH3 C) C2H7N
D) CH3 COO CH2 CH3 D) CH5N
E) CH3 COOH CH2 CH3 E) C3H9N2
9. Cual es nombre la siguiente estructura: 14. Hallar el producto orgánico de la reacción:
O O CH3-CH2-COOH + NH3
II II
CH3-C -C-CH3 A) CH3-CH2-CONH2
B) CH3-CH2- CH2-NH2
A) Butanona C) CH3- CH2-C≡N
B) 2-ceto-cutanona D) CH3- CH-COOH
C) butanodiona NH2
D) 2,3-butanodiona E) NH2CH2- CH2-COOH
E) dibutanona
10. El nombre IUPAC de la siguiente 15. El nombre del compuesto es:
estructura:
OH
CH3 -N – CH2 – CH2– CH3
I
CH3
A) dimetilpropilamina
B) propanamida
C) N,N-dimetilpropanamina
CH2 CH2CH3 D) N-metil-N-metilpropanamina
A) 5-propil-1-hexano E) Las claves A y C son correctas
B) 3-propilhexanol
C) 1-propil-3-ciclohexanol
D) 1-propilciclohexano-3-ol
E) 3-propilciclohexanol
CEPRE-UNALM 2 CICLO DE REGULAR 2011– II
16. La relación correcta, es: 2 NaOH H 2 SO4 Na2 SO4 2 H 2O , son:
A) Amida: R CH2 NH2 A) 40
B) Nitrilo: R CO NH2 B) 160
C) Amina: R CH2 CN C) 60
D) Aminoácido: HOOC CH2 NH2 D) 50
E) Lípido: R O R’ E) 80
17. Indicar verdadero (V) o falso (F)
( ) El glucógeno y el almidón son 22. Una muestra de aluminio impuro que
polisacáridos de reserva pesaba 90g reaccionó con ácido sulfúrico y
( ).A las aminas se les conoce como bases se desprendieron 56 litros de H2 medidos
orgánicas en C.N. Hallar el porcentaje de aluminio
( ) El metanol es un líquido transparente puro en la muestra. La reacción es:
muy tóxico que puede provocar ceguera. 2Al + 3H2SO4 Al2(SO4)3 + 3H2
( ) El etanol es metabolizado por la enzima Dato: Al (PA=27)
alcohol deshidrogenasa. A) 20
( )Al azúcar invertido se forma de la B) 40
hidrólisis de la lactosa C) 50
( )La fructosa puede ser consumida por D) 65
pacientes diabéticos E) 80
18. La estructura se denomina:
23. Los litros de agua que deben agregarse a
O 500 mililitros de una solución acuosa de
NaCl 1M para convertirla en 0,2M son:
N CH2CH3 A) 2,5
B) 2
H C) 2500
D) 2000
A) N-etil-N-hidrógenobenzamida E) 4
B) isopropilbenzamina
C) N-etil-N-hidrógenobenzamina
D) N-etilanilina
24. La relación correcta es:
E) N-etilbenzamida
A) KCl : sal oxisal
B) H2SO3 : ácido hidrácido
19. El aminoácido valina tiene la siguiente
C) NaHSO4 : ácido oxácido
estructura D) MgH2 : hidruro no metálico
COOH- CH-CH-CH3
E) NH4Cl : sal haloidea
I I
NH2 CH3
25. En la siguiente reacción redox:
Ca+Cl2 CaCl2
Su nombre según el sistema IUPAC es:
A) Cada mol de calcio pierde 2é
A) Ácido 2-metil-3-aminobutanoico
B) Cada mol de Cl2 gana 6,022x1023
B) Ácido 3-amino-2 metilbutanoico
electrones
C) Ácido 2-amino-3-metil-1-butanoico
C) Cada molécula de Cl2 gana 2é
D) Ácido 2-amino-3-metilbutanoico D) Cada átomo de calcio pierde 2x
E) Ácido 3 metil-2-aminobutanoico
6,022X1023)electrones
E) 1mol de calcio reacciona con una
20. El número de átomos totales que existen en
molécula de Cl2
4 moles de Al2(SO4)3 es:
A) 68
B) 68x6,022x1023
C) 17
D) 68/6,022x1023
E) 17x6,022x1023
21. Los litros de solución de NaOH 0,2 M que
se requieren para neutralizar totalmente 8
moles de ácido sulfúrico según:
CEPRE-UNALM 3 CICLO DE REGULAR 2011– II
26. Si la fórmula del dicromato de sodio es 31. Señalar las proposiciones correctas:
Na2Cr2O7 , entonces, la fórmula del
dicromato de hierro (III) es: Tipo de G.electrónica
A) Fe2Cr2O7 Molécula Hidridación y
B) FeCr2O7 G.molecular
C) Fe3(Cr2O7)2
D) Fe4Cr2O7
E) Fe2(Cr2O7)3
27. Indicar la familia y el nombre de cada
compuesto inorgánico
a. CaCO3...................................................................................
b. HCl(ac)....................................................................................
c. H2CO3...................................................................................
d. Cl2O7.....................................................................................
e. HBr(g)………………………………………………..……………
28. La base conjugada del oxianión bicarbonato
(HCO31- ) es:
A) H2CO3
B) CO32-
C) CO2
D) CO
E) H2CO4
29. Si la fórmula del ácido es H2MnO4
entonces la fórmula de manganato de
estaño (II) es:
A) Sn(MnO4 )2 32. Si el ión 13X3+ tiene igual número de
B) SnMnO4 electrones que ion Y-1,entonces el átomo Y
C) SnHMnO4 es de un elemento que pertenece a la
D) Sn2(MnO4)3 familia de los:
E) Sn2MnO4 A) Metales alcalinos
B) Metales alcalino-térreos
C) Anfígenos
30. Cuando el ácido butanoico se disuelve en D) Halógenos
agua las fuerzas intermoleculares que se E) Gases nobles
presentan son:
A) Dispersión de London, ión dipolo y 33. Los números cuánticos del último electrón
puente de hidrógeno del catión A1+ son (3, 1, +1, -1/2), entonces,
B) Dispersión de London y ión dipolo en qué grupo y periodo se ubica el
C) Dispersión de London y puente de elemento “A”
hidrógeno A) VIIA y 3
D) Puente de hidrógeno y dipolo-dipolo B) VA y 3
E) Dispersión de London y dipolo-dipolo C) IIA y 4
D) VIA y 3
E) IA y 4
CEPRE-UNALM 4 CICLO DE REGULAR 2011– II
Respuestas
1.- A 13. C 25. C
2. 14. A 26. E
C
3. E 15. E 27. -
4. C 16. D 28. B
5. - 17. VVVVFV 29. B
6. - 18. E 30 C
7. B 19. D 31. -
8. 20. B 32. D
D
9. C 21. E 33. E
10. E 22. C
11. B 23. B
12. C 24. E
CEPRE-UNALM 5 CICLO DE REGULAR 2011– II
You might also like
- Hid Ro Carb UrosDocument2 pagesHid Ro Carb UrosnelsonramzNo ratings yet
- Guia de Ejercicio Quimica OrganicaDocument25 pagesGuia de Ejercicio Quimica OrganicasirazaghalNo ratings yet
- HIDROCARBUROSDocument3 pagesHIDROCARBUROSJose Miguel Quito PinedoNo ratings yet
- 1-Quimica Organica I-Hidrocarburos (Ciclicos-Aciclicos) - QuimicaDocument8 pages1-Quimica Organica I-Hidrocarburos (Ciclicos-Aciclicos) - QuimicaRous OchanteNo ratings yet
- Ejercicios Propuestos Compuestos Carbonilicos 2016-IIDocument2 pagesEjercicios Propuestos Compuestos Carbonilicos 2016-IIAfir MinayaNo ratings yet
- Guía HIDROCARBUROSDocument22 pagesGuía HIDROCARBUROSVale100% (3)
- Sem 7Document5 pagesSem 7RONALD VILCA CACERESNo ratings yet
- Guia de Ejercicios Grupos FuncionalesDocument5 pagesGuia de Ejercicios Grupos FuncionalesBrenda ValencianoNo ratings yet
- Prueba Química OrgánicaDocument2 pagesPrueba Química OrgánicaPaola GutiNo ratings yet
- Prueba C-1 Quimica OrgánicaDocument5 pagesPrueba C-1 Quimica OrgánicaNaty Ortega MuñozNo ratings yet
- Formulación OrgánicaDocument32 pagesFormulación OrgánicaJuan RamónNo ratings yet
- Seminario Sem 12 Quimica Organica II AgostoDocument2 pagesSeminario Sem 12 Quimica Organica II AgostoBrainBerniePeñaPeinadoNo ratings yet
- Compuestos Oxigenados OrgánicosDocument2 pagesCompuestos Oxigenados OrgánicosJuan Carlos Ríos Martínez100% (1)
- Química orgánica: Funciones oxigenadas y nitrogenadasDocument54 pagesQuímica orgánica: Funciones oxigenadas y nitrogenadasoscar sebastian vela reateguiNo ratings yet
- 1er Examen Ejer - FormulacionDocument5 pages1er Examen Ejer - FormulacionJonathan CBNo ratings yet
- Quiz Recup Aldehidos y CetonasDocument1 pageQuiz Recup Aldehidos y CetonasAlexander Daza0% (1)
- Hidrocarburos-40Document6 pagesHidrocarburos-40JesusemiliozerpaNo ratings yet
- Nomenclatura Organica OxigenadasDocument2 pagesNomenclatura Organica OxigenadasDelincuente BuscadoNo ratings yet
- Ht-2 - Hidrocarburos - Alcanos, Alquenos AlquinosDocument4 pagesHt-2 - Hidrocarburos - Alcanos, Alquenos AlquinosAlex RyanNo ratings yet
- Quimica OrganicaDocument12 pagesQuimica OrganicaFrank FasanandoNo ratings yet
- Ejercicios Química OrgánicaDocument18 pagesEjercicios Química OrgánicaDaniel Zednanreh ZeugnimodNo ratings yet
- Clases Quimica - IIDocument4 pagesClases Quimica - IIEsther Esther0% (1)
- Taller de Nomenclatura OrgánicaDocument2 pagesTaller de Nomenclatura OrgánicaEdwin QuirogaNo ratings yet
- Guía para Examen de Grupos FuncionalesDocument1 pageGuía para Examen de Grupos Funcionalesmarnah79100% (1)
- Hoja de Trabajo No. 1 Química OrgánicaDocument1 pageHoja de Trabajo No. 1 Química OrgánicaajumayenaNo ratings yet
- Ejercicios de HidrocarburosDocument3 pagesEjercicios de HidrocarburosLuis SilvaNo ratings yet
- 2da Actividad Química 5to 2do Momento 20-21Document2 pages2da Actividad Química 5to 2do Momento 20-21SaletYabourNo ratings yet
- 6481-Miniensayo #8 Química 2015Document9 pages6481-Miniensayo #8 Química 2015Paola Espinoza PulgarNo ratings yet
- Nombramiento de compuestos orgánicosDocument11 pagesNombramiento de compuestos orgánicosorlando toroNo ratings yet
- Guía de Ejercicios de Alcanos y AlquenosDocument3 pagesGuía de Ejercicios de Alcanos y AlquenosRocio Marivel Cristobal TaypeNo ratings yet
- Alcanos y radicales saturados: nomenclaturaDocument24 pagesAlcanos y radicales saturados: nomenclaturaaileengriselNo ratings yet
- Estructura orgánica y grupos funcionalesDocument3 pagesEstructura orgánica y grupos funcionalesFrancisco AlexisNo ratings yet
- Preguntas de Química OrgánicaDocument13 pagesPreguntas de Química OrgánicaFamilia Solis SobarzoNo ratings yet
- Ejer Cici OsDocument15 pagesEjer Cici OsAngel Jesus Méndez RamírezNo ratings yet
- Evaluación Final Modelo Q IIDocument3 pagesEvaluación Final Modelo Q IIlilipNo ratings yet
- Guia Grupos Funcionales 2° Medio 2011Document10 pagesGuia Grupos Funcionales 2° Medio 2011GSebastianPicoNo ratings yet
- Química Orgánica I - Prueba 1Document2 pagesQuímica Orgánica I - Prueba 1Valeriita Marisol BasantesNo ratings yet
- QC13B 02 09 13Document8 pagesQC13B 02 09 13Pao NajisNo ratings yet
- DW Taller de Nomenclatura y Propiedades Físicas de AlcoholesDocument1 pageDW Taller de Nomenclatura y Propiedades Físicas de AlcoholesAngie OrtizNo ratings yet
- QuímicaDocument2 pagesQuímicaFernanda MaloNo ratings yet
- Alcohol y FenolDocument5 pagesAlcohol y FenolCarlos SalvioniNo ratings yet
- Ensayo Química Orgánica 4º MedioDocument8 pagesEnsayo Química Orgánica 4º MedioVanessa Alejandra Mera Viveros50% (2)
- Ejercicios Nomenclatura Eteres y EsteresDocument3 pagesEjercicios Nomenclatura Eteres y EsteresEstefania OrellanaNo ratings yet
- Grupos Funcionales NomenclaturaDocument17 pagesGrupos Funcionales NomenclaturaMarianet ZereneNo ratings yet
- Quimica 4 Medio Haluros de AlquiloDocument21 pagesQuimica 4 Medio Haluros de AlquiloAndrea GutierrezNo ratings yet
- Concentraciones químicasDocument5 pagesConcentraciones químicasSusiEcheverri100% (1)
- Estructura de Compuestos OrgánicosDocument54 pagesEstructura de Compuestos OrgánicosGer TableNo ratings yet
- Evaluación de Química Orgánica PDFDocument8 pagesEvaluación de Química Orgánica PDFLuis ZamoraNo ratings yet
- Seminario Sem 11 Quimica OrganicaDocument2 pagesSeminario Sem 11 Quimica OrganicaBrainBerniePeñaPeinadoNo ratings yet
- Ejercicios de alcanos, alquenos y alquinosDocument4 pagesEjercicios de alcanos, alquenos y alquinosCatherine Magnolia Carrasco SuasacaNo ratings yet
- Química Del CarbonoDocument6 pagesQuímica Del CarbonoMiguel Angel Criado AlonsoNo ratings yet
- Ejer Repaso OrganicaDocument2 pagesEjer Repaso OrganicaLoliMéndezNo ratings yet
- Taller Éteres Grado 11 QuímicaDocument2 pagesTaller Éteres Grado 11 QuímicaJhonatan AstudilloNo ratings yet
- GUIAORGANICA2ADocument3 pagesGUIAORGANICA2ANataly Neira GuzmánNo ratings yet
- Respuestas Guia de Ejercicios Nomenclatura Grupos FuncionalesDocument6 pagesRespuestas Guia de Ejercicios Nomenclatura Grupos FuncionalesErika AlfaroNo ratings yet
- Qui Semi7 2011-IDocument5 pagesQui Semi7 2011-IYurico Peña SusayaNo ratings yet
- Qui Seminario7 2010-IIDocument5 pagesQui Seminario7 2010-IImiabenavideschavezNo ratings yet
- Seminario final de química UNALMDocument5 pagesSeminario final de química UNALMAndreu Solorzano BellidoNo ratings yet
- Seminario Dominical p21Document6 pagesSeminario Dominical p21ximena santa cruzNo ratings yet
- Qui Semi5 Int2012Document5 pagesQui Semi5 Int2012enrrique UNo ratings yet
- Documento Archivo.Document1 pageDocumento Archivo.enrrique UNo ratings yet
- Bio Ase2 2017-IDocument5 pagesBio Ase2 2017-Ienrrique UNo ratings yet
- Para Otros Usos de Este Término, Véase .: Ir A La Navegaciónir A La BúsquedaDocument4 pagesPara Otros Usos de Este Término, Véase .: Ir A La Navegaciónir A La Búsquedaenrrique UNo ratings yet
- Documento ArchivoDocument1 pageDocumento Archivoenrrique UNo ratings yet
- Qui Semi5 Int2012Document5 pagesQui Semi5 Int2012enrrique UNo ratings yet
- Qui Semi7 2011-IIDocument5 pagesQui Semi7 2011-IIenrrique UNo ratings yet
- Simulacro (Tipo Admisión Unalm) - Matematicasn 2018Document20 pagesSimulacro (Tipo Admisión Unalm) - Matematicasn 2018enrrique UNo ratings yet
- Bio Semi1 2011-IIDocument8 pagesBio Semi1 2011-IIPerlita La ChoclonitaNo ratings yet
- BoletaPago 74963486Document1 pageBoletaPago 74963486enrrique UNo ratings yet
- Bio Ase2 2017-IDocument5 pagesBio Ase2 2017-Ienrrique UNo ratings yet
- Bio Semi1 2011-IIDocument8 pagesBio Semi1 2011-IIPerlita La ChoclonitaNo ratings yet
- Bio Semi1 2011-IIDocument8 pagesBio Semi1 2011-IIPerlita La ChoclonitaNo ratings yet
- Bio Ase2 2017-IDocument5 pagesBio Ase2 2017-Ienrrique UNo ratings yet
- Qui Semi5 Int2012Document5 pagesQui Semi5 Int2012enrrique UNo ratings yet
- Qui Semi5 Int2012Document5 pagesQui Semi5 Int2012enrrique UNo ratings yet
- Bio Semi1 2011-IIDocument8 pagesBio Semi1 2011-IIPerlita La ChoclonitaNo ratings yet
- FT Rodanol Roscalit-Zn2Document3 pagesFT Rodanol Roscalit-Zn2Ismael AndradeNo ratings yet
- Tema6-Equilibrio en Fase Acuosa-Reacciones Acido-BaseDocument45 pagesTema6-Equilibrio en Fase Acuosa-Reacciones Acido-BaseCarlo M. ChahuaraNo ratings yet
- Notas de Bota DielectricaDocument1 pageNotas de Bota DielectricaAlina UgaldeNo ratings yet
- ESTANDARIZACION DE UNA SOLUCION DE HIDROXIDO DE SODIO y HCL 0.085N Practica 3Document3 pagesESTANDARIZACION DE UNA SOLUCION DE HIDROXIDO DE SODIO y HCL 0.085N Practica 3Isabel Carpio GüimackNo ratings yet
- Análisis de Precio Unitario-ActualizadoDocument148 pagesAnálisis de Precio Unitario-Actualizadoaguila33379% (14)
- 6º - 13611 - Procesos de Fabricacion 1 - 2013Document3 pages6º - 13611 - Procesos de Fabricacion 1 - 2013Ross Mabel Ojeda de GarayNo ratings yet
- Lu ZZZZZZ ZZZZZZZ ZZZZZZZZ ZZZZZZZZDocument21 pagesLu ZZZZZZ ZZZZZZZ ZZZZZZZZ ZZZZZZZZAnonymous azBfzKK4No ratings yet
- Práctica 3 Lab FísicaDocument9 pagesPráctica 3 Lab FísicaAna Sofìa Lanza MartínezNo ratings yet
- Laboratorio Dukay S. A Hoja de Datos de Seguridad: El Taqueral 454 - Santiago - ChileDocument2 pagesLaboratorio Dukay S. A Hoja de Datos de Seguridad: El Taqueral 454 - Santiago - ChileSheyla Claudia Barriga CuadrosNo ratings yet
- Índice de Peróxido e Índice de Acidez y % de Acidos Grasos LibresDocument16 pagesÍndice de Peróxido e Índice de Acidez y % de Acidos Grasos Libresluz arelaNo ratings yet
- VNMHDocument20 pagesVNMHErnestina Ruiz VillamarinNo ratings yet
- Trabajo Investigación Química OrgánicaDocument4 pagesTrabajo Investigación Química Orgánicarodrigo barrigaNo ratings yet
- Obtencion de AlumbreDocument9 pagesObtencion de AlumbreAna Esther Serpa SaezNo ratings yet
- Suplementacion Con Hierro y MicronutrientesDocument4 pagesSuplementacion Con Hierro y MicronutrientesCristhina Pérez100% (2)
- Investigación 1 1Document10 pagesInvestigación 1 1Giis LifeNo ratings yet
- Tema 1identificación de Los Materiales y Elementos MecánicosDocument30 pagesTema 1identificación de Los Materiales y Elementos MecánicosMatías GonzaNo ratings yet
- Paté de FruitDocument1 pagePaté de FruitAnonymous WFiLkjhrNo ratings yet
- AlcanosDocument27 pagesAlcanosAlma YadiraNo ratings yet
- ¿Cuál Es El Protocolo de Limpieza de Salas Blancas?Document2 pages¿Cuál Es El Protocolo de Limpieza de Salas Blancas?IS CleanroomsNo ratings yet
- Clase 13 Disoluciones I Mezclas Disoluciones y Unidades Porcentuales de ConcentraciónDocument26 pagesClase 13 Disoluciones I Mezclas Disoluciones y Unidades Porcentuales de ConcentraciónLisi Gómez100% (2)
- Análisis GranulometricoDocument12 pagesAnálisis GranulometricoKevin PizarroNo ratings yet
- Algunas Desventajas de Los Aceites SinteticosDocument2 pagesAlgunas Desventajas de Los Aceites SinteticosFrancisco UyaguariNo ratings yet
- Disolventes y cetonasDocument3 pagesDisolventes y cetonasNancy FonsecaNo ratings yet
- AnfoDocument31 pagesAnfoEdson Isaac Mamani100% (2)
- Ingredientes y aditivos empleados en industria cárnicaDocument8 pagesIngredientes y aditivos empleados en industria cárnicaKleyder Ramirez PuertaNo ratings yet
- Ficha Tecnica 700PDocument1 pageFicha Tecnica 700PjoelNo ratings yet
- Melissa Olivares FloresDocument1 pageMelissa Olivares FloresRafael Ramirez OrozcoNo ratings yet
- Gas de Purga INTERPURGE-Catalog208-SpanishDocument24 pagesGas de Purga INTERPURGE-Catalog208-SpanishrobertNo ratings yet
- Determinación de ácido acético en vinagreDocument17 pagesDeterminación de ácido acético en vinagreRosarioNo ratings yet
- Redox Problemas ResueltosDocument55 pagesRedox Problemas ResueltosTACURI PEREZ BILLY JHONSON JOENo ratings yet