Professional Documents
Culture Documents
ADN
Uploaded by
Samantha MT0 ratings0% found this document useful (0 votes)
223 views3 pagesOriginal Title
ADN.docx
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
223 views3 pagesADN
Uploaded by
Samantha MTCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 3
Instituto Politécnico Nacional
Escuela Nacional de Ciencias Biológicas
Laboratorio de Bioquímica General
4QV1 Sección 4
Caracterización espectrofotométrica del DNA y separación de bases
nitrogenadas e hidrolizados de DNA y RNA por cromatografía en placa
fina
Objetivos 300 -0.001 0.084 -0.164 -0.188 0.056
Mediante las absorbancia obtenidas <1 de 260nm
Separar las bases nitrogenadas del DNA y el en este caso se presentaron 3 diluciones 1:50,
RNA por cromatografía en capa fina a partir 1:150, 1:200 se calculó la concentración en
de hidrolizados de los mismos, mg/mL con la siguiente formula.
identificándolas por la propiedad que tienen
de absorber luz UV. 𝑥(0.05) 𝑚𝑔
=
Identificar el espectro de absorción del DNA 1 𝑚𝐿
a partir de un método espectrofotométrico y 0.802(0.05)
= 0.0401𝑚𝑔/𝑚𝐿
obtener su pureza. 1
0.665(0.05)
1
= 0.03325𝑚𝑔/𝑚𝐿
Resultados y discusión
0.701(0.05)
= 0.03505𝑚𝑔/𝑚𝐿
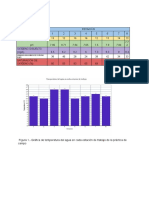
Tabla I. Absorbancias obtenidas a diferentes 1
longitudes de onda de diferentes diluciones de Esta concentración se encuentra en una dilución
una solución de DNA marcando las absorbancias 1:100,1:150,1:200 por lo tanto la concentración
de 260nm (para DNA) y 280nm (para proteinas) del extracto original es de 4.01, 4.9875,
7.01mg/mL
Longitud de Absorbancia
onda (nm) Blanco 1:50 1:100 1:150 1:200
200 0.040 -0.030 -0.010 0.110 0.419
205 0.139 0.130 0.235 0.249 0.139
210 -0.301 -0.076 0.179 0.005 -0.225
215 0.071 0.628 0.418 0.375 0.568
220 0.001 1.215 0.225 0.219 0.499
225 0.007 1.051 0.059 0.071 0.423
230 0.001 0.799 -0.009 0.005 0.356
235 -0.001 0.785 0.028 0.033 0.351
240 -0.002 1.000 0.177 0.155 0.415
245 -0.001 1.326 0.379 0.314 0.498
250 -0.001 1.662 0.567 0.469 0.578
255 0.001 1.809 0.719 0.592 0.663
260 -0.003 2.019 0.802 0.665 0.701
265 -0.001 2.083 0.845 0.685 0.706
270 0 2.057 0.807 0.660 0.676 Figura 1. Nomograma con el cálculo de DNA y
275 -0.001 1.793 0.657 0.522 0.564
proteínas con las absorbancias obtenidas a 280 y
280 0.001 1.469 0.472 0.363 0.420
260nm
285 -0.001 1.104 0.273 0.189 0.273
290 -0.001 0.679 0.074 0.016 0.122
295 0 0.330 -0.071 -0.109 0.014
Para la prueba espectrofotométrica se realizaron no son confiables por lo ya descrito
diferentes diluciones a partir de las cuales anteriormente.
elegimos aquella cuyo espectro tuviera una
mayor absorbancia a 260nm que es el rango
máximo de absorción de luz del DNA. También
observamos la absorción a 280nm pues éste es
el rango de absorción de las proteínas y un pico
en ésta longitud de onda es un indicador de
contaminación de origen proteico. Así que en
base a esto determinamos la pureza del DNA.
Se obtuvo como resultado del nomograma
concentraciones diferentes sin embargo
encontramos que al intersectar los valores de la
dilución 1:150 el valor de proteínas salía cercano
a 0, lo cual es imposible ya que este contenía
proteínas, por lo cual los valores de esta dilución
se podrían descartar posteriormente las
diluciones 1:100 resulto una concentración de
proteínas de 0.012 mg/mL y de ácidos nucleicos Figura 2. Cromatograma de soluciones de las
de 0.032 mg/mL, mientras que 1:200 nos dio una diferentes bases púricas y pirimidícas, con
concentración de 0.08mg/mL y 0.030 mg/mL soluciones de DNA y RNA.
respectivamente, mientras que la concentración
del extracto fue de 2.005 y 7.01mg/mL DNA Tabla II. Rf de las soluciones de las diferentes
respectivamente. bases púricas y pirimidícas, y basado en el
Podemos observar en la Tabla I, los valores de cromatograma identificar cuales están presentes
las diluciones son muy dispersos y estos no en el DNA y en el RNA.
concuerdan ya que esperaríamos que conforme
Rf DNA RNA
vamos aumentando la dilución, la absorbancia
Citosina 0.266 ✓ ✓
vaya disminuyendo. Esto se puede deber a que
Guanina 0.4 ✓ ✓
cada equipo realizo una dilución diferente por lo
Adenina 0.533 ✓ ✓
cual cada persona tiene errores de analista
Uracilo 0.653 ✓
diferente lo cual aumenta la probabilidad de
Timina 0.733 ✓
error, además que las pipetas y tubos usados no
En la cromatografía en placa fina se hicieron
fueron lavados previamente provocando que se
aplicaciones de las bases nitrogenadas que
agregaran impurezas e interfiriendo en los
componen los ácidos nucleicos; adenina, timina,
valores de absorbancia.
guanina y citosina para DNA y para RNA
Se tomaron los datos de la dilución 1:100 ya que únicamente se reemplaza la timina por uracilo.
al compararlo con los resultados del nomograma Además de las aplicaciones de bases
fue el que más parecido tuvo, el valor obtenido nitrogenadas también se realizaron dos de DNA y
del nomograma del extracto crudo fue de 3 y el RNA.
valor obtenido con las diluciones fue de 4.01.
El fin de llevar a cabo dicho proceso con éstas
Pureza sustancias en específico es demostrar en base a
la mancha revelada con luz UV qué componentes
𝐴𝑏𝑠 260𝑛𝑚 tienen cada uno de los ácidos nucleicos. La
= 𝑃𝑢𝑟𝑒𝑧𝑎
𝐴𝑏𝑠 280𝑛𝑚 diferencia de corrimientos se debe a su
0.802 0.701 estructura y afinidad con el eluyente empleado.
0.472
= 1.699 0.420
= 1.669
Basándonos en los resultados obtenidos (la
Con el resultado obtenido podemos concluir que Figura 2 y la Tabla II) podemos confirmar que las
el extracto de DNA es puro ya que el resultado bases púricas Adenina y Guanina, y la base
de la división fue >1.5, sin embargo estos datos
pirimidíca Timina, están presentes en ambos
ácidos nucleicos. La diferencia entre estos
ácidos nucleico se observa claramente que el
DNA presenta Citosina pero no Uracilo y al
contrario el RNA presenta Uracilo pero no
Citosina.
Conclusiones
El extracto de DNA tenía una pureza de
alrededor de 1.7
EL extracto contenía alrededor de 3mg/mL
según el nomograma y 4.01mg/mL según el
primer método.
El DNA está compuesto por Adenina, Timina
Guanina y Citosina
El RNA está compuesto por Adenina, uracilo,
guanina y citosina
El espectro de absorción del DNA se
encuentra con un máximo a 260nm
Bibliografía
G. Gómez, “Bioquímica, la ciencia de la
vida”, Editorial de la Universidad Estatal a
Distancia, Costa Rica (2004).
L. Pacheco, “Bioquímica Médica”, Editorial
LIMUSA, México (2004).
You might also like
- Introduccion: ResultadosDocument3 pagesIntroduccion: ResultadosLuis RojasNo ratings yet
- Bioquìmica ENCB DNA VegetalDocument3 pagesBioquìmica ENCB DNA VegetalDioney TellezNo ratings yet
- Cromatografia Por AdsorcionDocument3 pagesCromatografia Por AdsorcionLi ClementeNo ratings yet
- ConjugaciónDocument56 pagesConjugaciónOmar PopocaNo ratings yet
- Practica 12 EcoDocument4 pagesPractica 12 EcoZuri ManriqueNo ratings yet
- Evaluación de Microorganismos Cultivables de AguaDocument5 pagesEvaluación de Microorganismos Cultivables de AguaPanchoNo ratings yet
- Oxido-Reductasas 2Document2 pagesOxido-Reductasas 2luis3felipe3lara3ortNo ratings yet
- Reporte de Práctica "Transformación y Caracterización de Plásmidos Recombinantes Bacterianos" Genética MicrobianaDocument8 pagesReporte de Práctica "Transformación y Caracterización de Plásmidos Recombinantes Bacterianos" Genética MicrobianaRicardoNo ratings yet
- Practica 4 Nitrato DisenoDocument3 pagesPractica 4 Nitrato DisenoAmandaNo ratings yet
- Actividad de La Fo DH Y RNasaDocument4 pagesActividad de La Fo DH Y RNasaChuck ÜbermenschNo ratings yet
- Practica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Document4 pagesPractica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Brenda M.No ratings yet
- Práctica N - 6. Caracterización Fenotípica y Física de ADN RecombinanteDocument10 pagesPráctica N - 6. Caracterización Fenotípica y Física de ADN RecombinanteMiguelYGracielaNo ratings yet
- Practica 2 Report eDocument10 pagesPractica 2 Report eEdson GonzalezNo ratings yet
- P. Inhibición Por Aceites Esenciales de PlantasDocument17 pagesP. Inhibición Por Aceites Esenciales de PlantasMartha Aleida DelNo ratings yet
- Practica 4 Fagos PDFDocument6 pagesPractica 4 Fagos PDFLuis AlcocerNo ratings yet
- Practica No 13Document5 pagesPractica No 13Shannejasiel GarzaNo ratings yet
- Practica 9 EcologiaDocument10 pagesPractica 9 EcologiamarthaNo ratings yet
- PDF Purificacion Parcial de Lisozima de Clara de Huevo - CompressDocument7 pagesPDF Purificacion Parcial de Lisozima de Clara de Huevo - CompressAlejandro Rodriguez Zenteno100% (1)
- Succinato DH 1432Document7 pagesSuccinato DH 1432AlejandraSánchezNo ratings yet
- Practica2 Balance de FermentaciónDocument45 pagesPractica2 Balance de FermentaciónWaalker Braandon100% (1)
- QuimiolitotrofíaDocument20 pagesQuimiolitotrofíaKevinVerdiDiLanterneNo ratings yet
- Regulación de La Síntesis de La B-Galactosidasa en Escherichia ColiDocument5 pagesRegulación de La Síntesis de La B-Galactosidasa en Escherichia ColiAbraham YehezkelNo ratings yet
- Practica Métodos Químicos de Analisis. ENCB. Electroforesis.Document5 pagesPractica Métodos Químicos de Analisis. ENCB. Electroforesis.teocraciachilzizNo ratings yet
- Práctica No. 13 Aislamiento Del DNA Plasmídico Lab. Bioquímica GeneralDocument4 pagesPráctica No. 13 Aislamiento Del DNA Plasmídico Lab. Bioquímica GeneralPaola VianeyNo ratings yet
- DNA Guayaba - Identificación Bases NitrogenadasDocument3 pagesDNA Guayaba - Identificación Bases NitrogenadasRosalba Hernández100% (1)
- Practica 2 Ecologia MicrobianaDocument5 pagesPractica 2 Ecologia MicrobianaMiguel LunaNo ratings yet
- Practica 5 Potencial de Accion y Simulacion Por ComputadoraDocument22 pagesPractica 5 Potencial de Accion y Simulacion Por ComputadoraAndresDuranNo ratings yet
- PRACTICACARBONODocument9 pagesPRACTICACARBONOBrenda M.No ratings yet
- Sustancias de ReservaDocument4 pagesSustancias de ReservaAlma KilmisterNo ratings yet
- Aislamiento de Dna PlasmídicoDocument2 pagesAislamiento de Dna PlasmídicoGuillermo CasillasNo ratings yet
- Discusión Halofílicos AmilolíticosDocument14 pagesDiscusión Halofílicos AmilolíticosOz HdzNo ratings yet
- Páctica 13. Degradación de SurfactantesDocument5 pagesPáctica 13. Degradación de SurfactantesDayana BlushNo ratings yet
- Reporte de Practica 1 FisiologiaDocument7 pagesReporte de Practica 1 FisiologiaHugoNo ratings yet
- Cuestionario 11Document4 pagesCuestionario 11David Ramírez100% (1)
- Pract 12 .ToxicidadDocument3 pagesPract 12 .ToxicidadmarthaNo ratings yet
- Estudio de Algunos Factores Que Afectan El Establecimiento de Un Método EspectrofotométricoDocument7 pagesEstudio de Algunos Factores Que Afectan El Establecimiento de Un Método EspectrofotométricoTuistwer GoparNo ratings yet
- Práctica 1 - Transporte de Glucosa en Levaduras Seccion 2Document38 pagesPráctica 1 - Transporte de Glucosa en Levaduras Seccion 2Tania Karen Rodriguez GarciaNo ratings yet
- Practica 11Document4 pagesPractica 11Hector0% (1)
- Sistema MultipleDocument10 pagesSistema MultipleGabriel López100% (1)
- P12 ToxicidadDocument4 pagesP12 ToxicidadJonathan R. EstradaNo ratings yet
- PRACTICANITROGENODocument9 pagesPRACTICANITROGENOBrenda M.No ratings yet
- Transferencia de Material Genético Por Conjugación en Escherichia Coli 1Document15 pagesTransferencia de Material Genético Por Conjugación en Escherichia Coli 1Pio AvilaNo ratings yet
- Discusion SuelosDocument60 pagesDiscusion SuelosVickyCervantesNo ratings yet
- Practica DNADocument2 pagesPractica DNASyg Delgado100% (1)
- PLAGUICIDASDocument14 pagesPLAGUICIDASLaura AlejandraNo ratings yet
- Practica 2 Balance de Fermentacion BuenaDocument7 pagesPractica 2 Balance de Fermentacion Buenadanieli123No ratings yet
- DNA PlasmídicoDocument2 pagesDNA PlasmídicoSuarez GOmez Alexis GabrielNo ratings yet
- Sistema MultipleDocument12 pagesSistema MultipleCrosszeriaNo ratings yet
- Determinación de Riboflavina Por FluorometriaDocument3 pagesDeterminación de Riboflavina Por FluorometriaLaLoo Flores CruzNo ratings yet
- HPLCDocument6 pagesHPLCDaniel JmzNo ratings yet
- Vdocuments - MX Practica 3 Determinacion de Actividad de Succinato Deshidrogenasa de EscherichiaDocument6 pagesVdocuments - MX Practica 3 Determinacion de Actividad de Succinato Deshidrogenasa de EscherichiaangelNo ratings yet
- P2 Conceptos Básicos de HomeostasisDocument11 pagesP2 Conceptos Básicos de Homeostasisangie creyesNo ratings yet
- Ecologia P6 Columnas Enriquecimiento y Estratificacion 4QM2 S1 Eq. 2 & 6Document18 pagesEcologia P6 Columnas Enriquecimiento y Estratificacion 4QM2 S1 Eq. 2 & 6Diego ReyesNo ratings yet
- Bitacora Obtención de DNA PlasmídicoDocument3 pagesBitacora Obtención de DNA PlasmídicoPauPauSánchezNo ratings yet
- Ecología 10Document7 pagesEcología 10Brenda M.No ratings yet
- Efecto de Concentración de Sustrato e Inhibición Enzimática.Document2 pagesEfecto de Concentración de Sustrato e Inhibición Enzimática.H VandortNo ratings yet
- Informe Acidos NucleicosDocument4 pagesInforme Acidos NucleicosjoseNo ratings yet
- Extracción y Purificación.Document8 pagesExtracción y Purificación.FANo ratings yet
- Práctica CuantificaciónDocument6 pagesPráctica CuantificaciónANAHI ORTIZ JIMENEZNo ratings yet
- Informe DNADocument4 pagesInforme DNANadia VargasNo ratings yet
- Simulación de Circuito Con DiodosDocument2 pagesSimulación de Circuito Con DiodosBryan Enrique TorresNo ratings yet
- Estructura Interna de La Tierra - PDFDocument3 pagesEstructura Interna de La Tierra - PDFBalya Grandez SantillánNo ratings yet
- Expo HuamanDocument7 pagesExpo HuamankevinestNo ratings yet
- 1º - Plan de Mejora y Ampliación MATDocument64 pages1º - Plan de Mejora y Ampliación MATPatricia Quirós HuertaNo ratings yet
- Vocabulario Técnico Mi-MtDocument3 pagesVocabulario Técnico Mi-MtJorge FloresNo ratings yet
- Guia de Diseño Lineas de Transporte Diseño Troncal ATEERADocument90 pagesGuia de Diseño Lineas de Transporte Diseño Troncal ATEERAGabriel GomezNo ratings yet
- La Marea Atmosférica o BarométricaDocument5 pagesLa Marea Atmosférica o BarométricaGerard FleurquinNo ratings yet
- Espacios de Estados.: 1.-Investigar Sobre El Espacio de Estados (Determinísticos y No Determinísticos)Document2 pagesEspacios de Estados.: 1.-Investigar Sobre El Espacio de Estados (Determinísticos y No Determinísticos)Laura Sanchez MexicanoNo ratings yet
- 2 Diseño de Un Sistema de Monitoreo, Registro y Control de Temperatura y Humedad para Un Cultivo de InvernaderoDocument79 pages2 Diseño de Un Sistema de Monitoreo, Registro y Control de Temperatura y Humedad para Un Cultivo de InvernaderoHans CastroNo ratings yet
- Turbinas Hidráulicas - Criterios de SelecciónDocument3 pagesTurbinas Hidráulicas - Criterios de SelecciónMarcos CarreroNo ratings yet
- Repaso Examen DDL DMLDocument2 pagesRepaso Examen DDL DMLTheGaMer ROTNo ratings yet
- BromoDocument3 pagesBromoErick LópezNo ratings yet
- Pro II Ejemplos 2Document98 pagesPro II Ejemplos 2Jose Miguel Lopez DelgadoNo ratings yet
- TesisDocument167 pagesTesissib3liusNo ratings yet
- Reparar Arranque 2Document3 pagesReparar Arranque 2Gabo EnriqueNo ratings yet
- Practicas de Geologia General Guia - PPDocument43 pagesPracticas de Geologia General Guia - PPmiguelNo ratings yet
- Dios Usa Lápiz Labial (Karen Berg)Document223 pagesDios Usa Lápiz Labial (Karen Berg)Analia Nawrath100% (3)
- Manual de UsuarioDocument7 pagesManual de UsuarioWilliams De la O GomezNo ratings yet
- Sesión de Multiploicación y División de FraccionesDocument8 pagesSesión de Multiploicación y División de FraccionesClau MontalbanNo ratings yet
- Trabajo de DidacticaDocument24 pagesTrabajo de DidacticaJamart MartNo ratings yet
- Cuadernillo Final Matemática 1Document53 pagesCuadernillo Final Matemática 1Gráfica ImpresionArteNo ratings yet
- Manual-Polar CorregidoDocument20 pagesManual-Polar CorregidoAarón ChávezNo ratings yet
- Unidad 1 Arquitectura Del SistemaDocument104 pagesUnidad 1 Arquitectura Del SistemaPatricia Peña PalominoNo ratings yet
- NTP 155Document6 pagesNTP 155Marioquis RamosNo ratings yet
- MAT - PROPORCIONES - 2 x50 - 11 AB - Duplex OkDocument2 pagesMAT - PROPORCIONES - 2 x50 - 11 AB - Duplex OkAlejandro Del RioNo ratings yet
- Propuesta de Investigación de MercadosDocument1 pagePropuesta de Investigación de MercadosMauricio OrozcoNo ratings yet
- Lectura de Un Encoder Con SimulinkDocument3 pagesLectura de Un Encoder Con SimulinkRafael Aguilar RiosNo ratings yet
- Parcial - Escenario 4: Historial de IntentosDocument19 pagesParcial - Escenario 4: Historial de IntentosAndres AlvaresNo ratings yet
- Estadistica Total 2021Document25 pagesEstadistica Total 2021Luis RojasNo ratings yet
- Los Quemadores de KHDDocument6 pagesLos Quemadores de KHDlevishamilton100% (2)