Professional Documents
Culture Documents
Sistema
Uploaded by
Eduardo Montes de OcaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Sistema
Uploaded by
Eduardo Montes de OcaCopyright:
Available Formats
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
SISTEMA Un sistema es un conjunto de objetos unidos por alguna forma de interaccin o Interdependencia. Cualquier conjunto de partes unidas entre s puede ser considerado un sistema, desde que las relaciones entre las partes y el comportamiento del todo sea el foco de atencin. Un conjunto de partes que se atraen mutuamente (como el sistema solar), o un grupo de personas en una organizacin, una red industrial, un circuito elctrico, un computador o un ser vivo pueden ser visualizados como sistemas. Cualquier entidad o conjunto constituido de partes interdependientes denominadas subsistemas los componentes que funcionan juntas en relacin evidencia de que un sistema no es una suma de elementos si no de un conjunto de elementos interrelacionados. Realmente, es difcil decir dnde comienza y dnde termina determinado sistema. Los lmites (fronteras) entre el sistema y su ambiente admiten cierta arbitrariedad. El propio universo parece estar formado de mltiples sistema que se compenetran. SISTEMA TERMODINAMICO Un sistema termodinmico est constituido por cierta cantidad de materia o radiacin en una regin del espacio que nosotros consideramos para su estudio. Al hablar de cierta regin del espacio, surge de manera natural el concepto de frontera, esto es, la regin que separa al sistema del resto del universo fsico. Esta frontera. en la mayora de los casos, est constituida por las paredes del recipiente que contiene al sistema (fluidos, radiacin electromagntica), o bien, su superficie exterior (trozo de metal, gota de agua, membrana superficial). Sin embargo, puede darse el caso de que la frontera del sistema sea una superficie abstracta, representada por alguna condicin matemtica como en el caso de una porcin de masa de un fluido en reposo o en movimiento. Es importante sealar que el sistema termodinmico y sus fronteras estn determinados por el observador. De hecho el observador determina el sistema a estudiar a travs de las restricciones que impone cuando lo elige para su estudio. Estas restricciones pueden ser de naturaleza geomtrica, mecnica o trmica. Las primeras estn impuestas a travs de paredes que confinan al sistema a una regin finita del espacio. Las mecnicas determinan como poder intercambiar energa con el sistema a travs de la transmisin de8 8 Notas para el curso de Fsica Universitaria 1 Termodinmica trabajo mecnico, incluyendo todos los equivalentes de este trabajo: el trabajo magntico, elctrico, qumico, electroqumico, etc.
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
SISTEMA CERRADO Son los sistemas que no presentan intercambio con el medio ambiente que los rodea, pues son hermticos a cualquier influencia ambiental. As, los sistemas cerrados no reciben ninguna influencia del ambiente, y por otro lado tampoco influencian al ambiente. No reciben ningn recurso externo y nada producen la acepcin exacta del trmino. Los autores han dado el nombre de sistema cerrado a aquellos sistemas cuyo comportamiento es totalmente determinado y programado y que operan con muy pequeo intercambio de materia y energa con el medio ambiente. El trmino tambin es utilizado para los sistemas completamente estructurados, donde los elementos y relaciones se combinan de una manera peculiar y rgida produciendo una salida invariable. Son los llamados sistemas mecnicos, como las mquinas. SISTEMA ABIERTO Son los sistemas que presentan relaciones de intercambio con el ambiente, a travs de entradas y salidas. Los sistemas abiertos intercambian materia y energa regularmente con el medio ambiente. Son eminentemente adaptativos, esto es, para sobrevivir deben reajustarse constantemente a las condiciones del medio. Mantienen un juego recproco con las fuerzas del ambiente y la calidad de su estructura es ptima cuando el conjunto de elementos del sistema se organiza, aproximndose a una operacin adaptativa. La adaptabilidad es un continuo proceso de aprendizaje y de auto-organizacin. Los sistemas abiertos no pueden vivir aislados. Los sistemas cerrados-esto es, los sistemas que estn aislados de su medio ambiente- cumplen el segundo principio de la termodinmica que dice que una cierta cantidad, llamada entropa, tiende a aumentar a un mximo. La conclusin es que existe una tendencia general de los eventos en la naturaleza fsica en direccin a un estado de mximo desorden. Sin embargo, un sistema abierto mantiene as mismo, un continuo flujo de entrada y salida, un mantenimiento y sustentacin de los componentes, no estando a lo largo de su vida en un estado de equilibrio qumico y termodinmico, obtenido a travs de un estado firme llamado homeostasis. Los sistemas abiertos, por lo tanto, evitan el aumento de la entropa y pueden desarrollarse en direccin a un estado decreciente orden y organizacin (entropa negativa).
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
SISTEMA TOTALMENTE AISLADO Es donde no entra ni sale nada, ni energa ni masa como podra considerarse un sistema cerrado una hielera por ejemplo siempre que no la abras, idealmente no hay intercambio de calor con el medio fuera de la hielera ni de adentro para a fuera.
ALREDEDORES La parte del universo que interacciona con el sistema constituye sus alrededores. La interaccin entre el sistema y sus alrededores estar caracterizada por los intercambios mutuos de masa y energa, en sus diversas formas, la energa puede intercambiarse por medios mecnicos o por medios no mecnicos, esto es por procesos de calentamiento o enfriamiento. FRONTERAS Es lo que pertenece al sistema y qu es lo que no. Lo que no pertenece al sistema puede ser parte de su supra sistema o directamente no ser parte.
SISTEMA CERRADO Un sistema cerrado es un sistema fsico (o qumico) que no interacciona con otros agentes fsicos situados fuera de l y por tanto no est conectado causalmente ni correlacionalmente con nada externo a l. Una propiedad importante de los sistemas cerrados es que las ecuaciones de evolucin temporal, llamadas ecuaciones del movimiento de dicho sistema solo dependen de variables y factores contenidos en el sistema. Para un sistema de ese tipo por ejemplo la eleccin del origen de tiempos es arbitraria y por tanto las ecuaciones de evolucin temporal son invariantes respecto a las traslaciones temporales. Eso ltimo implica que la energa total de dicho sistema se conserva, de hecho, un sistema cerrado al estar aislado no puede intercambiar energa con nada externo a l. El universo entero considerado como un todo es probablemente el nico sistema realmente cerrado, sin embargo, en la prctica muchos sistemas no completamente aislados pueden estudiarse como sistemas cerrados con un grado de aproximacin muy bueno o casi perfecto.
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
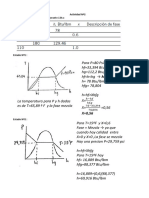
SISTEMA ABIERTO Un sistema abierto es un sistema fsico (o qumico) que interacciona con otros agentes qumicos, por lo tanto est conectado correlacionadamente con factores externos a l. Una propiedad importante de los sistemas abiertos es que las ecuaciones de evolucin temporal, llamadas "ecuaciones del movimiento" de dicho sistema no dependen de variables y factores contenidas en el sistema. Para un sistema de ese tipo por ejemplo la eleccin del origen de tiempos es exacta. El sistema de informacin abierto es mucho ms importante que el cerrado porque de l pueden depender otras plataformas del sistema, las cuales pueden necesitar cdigos o informacin que estn introducidas en el mismo. En pocas palabras el sistema abierto es preferencial en otros sistemas del sistema por completo.(ejemplo de un sistema abierto, figura 2).
SISTEMA AISLADO Un sistema aislado es aquel que no puede intercambiar ni energa ni materia (masa) con su entorno. Este as como lo dice su nombre es aislado, por lo que no interacta con el medio ambiente y no cambia de su energa un claro ejemplo es: 1. - El termo ya que este no cambia de materia y su temperatura es nica (estos sistemas aislado no son en su totalidad perfectos, ya que con el tiempo estos son afectados) 2. - Otro es el universo ya que no cumple ningn intercambio. La energa se transforma en calor y aumenta el desorden
PRROCESOS TERMODINAMICOS
PROCESO ADIABTICO.
Se designa como proceso adiabtico a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabtico que es adems reversible se conoce como proceso isentrpico. El trmino adiabtico hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un lmite adiabtico. Otro ejemplo es la temperatura adiabtica de una llama, que es la temperatura que podra alcanzar una llama si no hubiera prdida de calor hacia el entorno. En climatizacin los procesos de humectacin (aporte de vapor de agua)
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
son adiabticos, puesto que no hay transferencia de calor, a pesar de que se consiga variar la temperatura del aire y su humedad relativa.
Durante un proceso adiabtico, la energa interna del fluido que realiza el trabajo debe necesariamente decrecer. Es decir, que en este tipo de procesos se tiene que Q = 0. Que de acuerdo con la primera ley de la termodinmica, tenemos que: Q= U +W Como Q =0, entonces, U = -W.
Esto quiere decir, que para un gas contenido en un cilindro provisto de un pistn, cuyas paredes no permiten la transferencia de calor al exterior, la variacin de energa interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema. PROCESO ISOTRMICO. En este proceso la temperatura permanece constante. Como la energa interna de una gas ideal slo es funcin de la temperatura, en un proceso isotrmico de un gas ideal la variacin de la energa interna es cero (U= 0) La curva hiperblica se conoce como isotrmica. De acuerdo con la primera ley de la termodinmica tenemos: Q = U +W. Como U = 0, entonces, Q=W
Este proceso se observa cuando en un pistn que contiene un gas, despus de suministrarle calor y producir cambios tanto en la presin como en el volumen su temperatura permanece constante.
PROCESO ISOBRICO. Es un proceso termodinmico en el cual la presin permanece constante, en este proceso, como la presin se mantiene constante, se produce una variacin en el volumen y por tanto el sistema realiza trabajo o se puede realizar trabajo sobre el sistema. De acuerdo con la primera ley de la termodinmica, tenemos: Q = U +W
EDUARDO ANTONIO MONTES DE OCA CAMPUZANO
Lo que quiere decir que en un proceso de tipo isobrico tanto el calor transferido como el trabajo realizado ocasiona una variacin de la energa interna. Proceso isomtrico En este proceso el volumen permanece constante, es decir que en este tipo de proceso el volumen no vara y por tanto el trabajo es igual a cero, lo que significa que W= 0. De acuerdo con la primera ley de la termodinmica tenemos: Q = U +W Como W=0, entonces Q = U
You might also like
- Sensibilidad y EspecificidadDocument3 pagesSensibilidad y EspecificidadEduardo Montes de OcaNo ratings yet
- Curva de Crecimiento en Un Sistema Cerrado en Medio LiquidoDocument3 pagesCurva de Crecimiento en Un Sistema Cerrado en Medio LiquidoEduardo Montes de Oca100% (1)
- Cap 2 (Estructura Del Sistema Financiero Mexicano)Document52 pagesCap 2 (Estructura Del Sistema Financiero Mexicano)Eduardo Montes de OcaNo ratings yet
- Carnes rojas microbiotaDocument15 pagesCarnes rojas microbiotaBerenice SantiagoNo ratings yet
- Mac Completo Rev 1Document41 pagesMac Completo Rev 1mdiaz7No ratings yet
- Catchem100 Sez2 Cromat EsDocument0 pagesCatchem100 Sez2 Cromat EsEduardo Montes de OcaNo ratings yet
- Mi05-3 4fDocument11 pagesMi05-3 4fmauNo ratings yet
- Manual de Practicas de MicrobiologiaDocument47 pagesManual de Practicas de Microbiologiaahmed16h100% (2)
- Acidos Carboxilicos.2Document66 pagesAcidos Carboxilicos.2Eduardo Montes de OcaNo ratings yet
- Calculos UfcDocument0 pagesCalculos UfcEduardo Montes de OcaNo ratings yet
- Tecnica de Vertido en PlacaDocument10 pagesTecnica de Vertido en PlacaAdams Q. Arana75% (4)
- Uno de Los Mayores Cambios Que Ha Experiment Ado La SociedadDocument13 pagesUno de Los Mayores Cambios Que Ha Experiment Ado La SociedadEduardo Montes de OcaNo ratings yet
- Celula 3 PDFDocument18 pagesCelula 3 PDFanon-20180891% (11)
- Uno de Los Mayores Cambios Que Ha Experiment Ado La SociedadDocument13 pagesUno de Los Mayores Cambios Que Ha Experiment Ado La SociedadEduardo Montes de OcaNo ratings yet
- Capítulo 4 - MECÁNICA DE FLUÍDOSDocument44 pagesCapítulo 4 - MECÁNICA DE FLUÍDOSLiLiJin WookNo ratings yet
- Fenomeno de Trasporte ArtDocument9 pagesFenomeno de Trasporte ArtCELENIA ETELVINA ÑOPE QUITONo ratings yet
- Caida de Los Cuerpos en FluidosDocument36 pagesCaida de Los Cuerpos en FluidosJuan LlanoNo ratings yet
- Actividad Nº1 - Edward - Condor.inche PDFDocument4 pagesActividad Nº1 - Edward - Condor.inche PDFEDWARD CELESTINO CONDOR INCHENo ratings yet
- Flujo Permanente en Conductos A PresionDocument22 pagesFlujo Permanente en Conductos A PresionDick Moscoso0% (1)
- Ley de DarcyDocument11 pagesLey de DarcyPintoFreddyNo ratings yet
- Anexo 3 - CuestionarioDocument3 pagesAnexo 3 - CuestionariovivianaNo ratings yet
- Volumen de Control en Sistemas de Tuberías y Accesorios.Document6 pagesVolumen de Control en Sistemas de Tuberías y Accesorios.Maycol Skate ParkNo ratings yet
- Enfriamiento Con Deshumidificación 2Document8 pagesEnfriamiento Con Deshumidificación 2Gal JhonNo ratings yet
- Cuestionario 2 - DBCADocument2 pagesCuestionario 2 - DBCAAngel Gaspar CruzNo ratings yet
- SILABO REFRIGERACION Y AIRE ACOND 2020-I UNT Visado Por JSBDocument5 pagesSILABO REFRIGERACION Y AIRE ACOND 2020-I UNT Visado Por JSBJairo Omar Yamunaque AbadNo ratings yet
- Difusor de AdmisionDocument23 pagesDifusor de Admisiongabriel BalcazaNo ratings yet
- 2.PPT Flujo HiperconcentradoDocument59 pages2.PPT Flujo HiperconcentradoAna DiazNo ratings yet
- Física IIDocument166 pagesFísica IIpirsssilaNo ratings yet
- Análisis de la instrumentación geotécnica instalada en un túnel en roca masivaDocument105 pagesAnálisis de la instrumentación geotécnica instalada en un túnel en roca masivayuliNo ratings yet
- Equipos de Refrigeracion Tipo Paquete y CascadaDocument9 pagesEquipos de Refrigeracion Tipo Paquete y Cascadaanon_14532936No ratings yet
- Analisis HazopDocument14 pagesAnalisis HazopDiana SarabiaNo ratings yet
- Notas de FluidosDocument197 pagesNotas de FluidossamyfismatNo ratings yet
- Tensión SuperficialDocument12 pagesTensión SuperficialSergio ChNo ratings yet
- Capitulo 1... Parte 2Document22 pagesCapitulo 1... Parte 2Charly MosquedaNo ratings yet
- Balance de Masa y Energia MatlabDocument0 pagesBalance de Masa y Energia MatlabMartin IztapalapaNo ratings yet
- Ejercicios de BombaDocument8 pagesEjercicios de BombaPablo Villarreal PJ100% (1)
- Resistencia subrasante pavimentosDocument41 pagesResistencia subrasante pavimentosmarcela Castro100% (1)
- Procedimientos para El Diseño de Intercambiadores de Calor de Tubo y CorazaDocument16 pagesProcedimientos para El Diseño de Intercambiadores de Calor de Tubo y CorazaFABGOILMANNo ratings yet
- Informe-Ecuacion de BernoulliDocument4 pagesInforme-Ecuacion de BernoulliOmar MedinaNo ratings yet
- Ley de FourierDocument4 pagesLey de FourierRusbel Emmanuel Melendez FonsecaNo ratings yet
- Fisica y Quimica Tema 3Document4 pagesFisica y Quimica Tema 3Carmen QueroNo ratings yet
- TP Nro 4 - 1er Principio Aplicado A Sistemas Abiertos Circulantes PDFDocument3 pagesTP Nro 4 - 1er Principio Aplicado A Sistemas Abiertos Circulantes PDFJuan Manuel Hernandez B.No ratings yet
- Taller de Física Estadistica-2019-2Document2 pagesTaller de Física Estadistica-2019-2Daniel Felipe Martinez VizcainoNo ratings yet